
【题目】常温下将0.100mol·L—1的NaOH溶液滴加到20mL 0.100mol·L—1的草酸(分子式为H2C2O4,二元弱酸)溶液中,滴加过程中,溶液中H2C2O4、HC2O4-、C2O42-的物质的量分数随pH的变化曲线如图所示,下列叙述正确的是
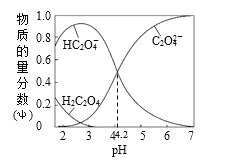
A.电离常数Ka1(H2C2O4)=10—4.2
B.当滴入10mLNaOH溶液时:c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-)
C.pH=7.0的溶液中:c(Na+)<2c(C2O42-)
D.当滴入20mLNaOH溶液时:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-)
【答案】BD
【解析】
A. pH=4.2时,c(HC2O4-)=c(C2O42-),则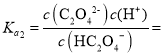 10—4.2,故A错误;
10—4.2,故A错误;
B. 根据电荷守恒,当滴入10mLNaOH溶液时:c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-),故B正确;
C. 根据电荷守恒,c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-),pH=7.0的溶液中c(Na+)=c(HC2O4-)+2c(C2O42-),所以c(Na+)>2c(C2O42-),故C错误;
D. 当滴入20mLNaOH溶液时草酸和氢氧化钠恰好反应生成NaHC2O4,根据质子守恒,c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-),故D正确。
答案选BD。


科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气标准状况,实验记录如表累计值:
时间 | 1 | 2 | 3 | 4 | 5 |
氢气体积 | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大__(填0~1、1~2、2~3、3~4、4~5min)。反应开始后反应速率先增大的原因是__。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率___(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入少量的下列溶液以减慢反应速率,你认为不可行的是__。
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。

①该反应的化学方程式是__。
②该反应达到平衡状态的标志是__。
A.X、Y、Z的反应速率相等
B.X、Y的反应速率比为3:1
C.容器内气体压强保持不变
D.生成2mol Z的同时生成3mol X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。完成下列计算:
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32 L(标准状况下)氮气,至少需要叠氮化钠________ g。
(2)钠—钾合金可在核反应堆中用作热交换液。5.05 g钠—钾合金溶于200 mL水生成0.075 mol氢气。
①计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化)。________
②计算并确定该钠-钾合金的化学式。______________
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应:2NaAl(OH)4+CO2―→2Al(OH)3↓+Na2CO3+H2O,己知通入二氧化碳336 L(标准状况下),生成24 mol Al(OH)3和15 mol Na2CO3,若通入溶液的二氧化碳为112 L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下反应可表示获得乙醇并用作汽车燃料的过程,下列有关说法正确的是
①6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g) ΔH1
②C6H12O6(s)=2C2H5OH(l)+2CO2(g) ΔH2
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3
A.2ΔH3=-ΔH1-ΔH2
B.在不同油耗汽车中发生反应③,ΔH3会不同
C.植物的光合作用通过反应①将热能转化为化学能
D.反应④C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH4,则ΔH3>ΔH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氰化钾(化学式为K3[Fe(CN)6])主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)铁元素在周期表中的位置为_________,基态Fe3+ 核外电子排布式为_________。
(2)在[Fe(CN)6]3- 中不存在的化学键有_________。
A. 离子键 B.金属键 C.氢键 D. 共价键
(3)已知(CN)2性质类似Cl2:
(CN)2+2KOH=KCN+KCNO+H2O KCN+HCl=HCN+KCl HC≡CH+HCN→H2C=CH-C≡N
①KCNO中各元素原子的第一电离能由小到大排序为________。
②丙烯腈(H2C=CH-C≡N)分子中碳原子轨道杂化类型是_______;分子中σ键和π键数目之比为_______。
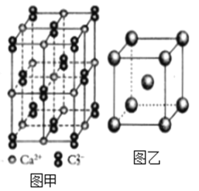
(4)C22-和N2互为等电子体,CaC2晶体的晶胞结构与NaCl晶体的相似(如图甲所示),但CaC2晶体中哑铃形的C22-使晶胞沿一个方向拉长,晶体中每个Ca2+周围距离最近的C22-数目为_______。
(5)金属Fe能与CO形成Fe(CO)5,该化合物熔点为-20℃,沸点为103℃,则其固体属于_______晶体。
(6)图乙是Fe单质的晶胞模型。已知晶体密度为dg·cm-3,铁原子的半径为_________nm(用含有d、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是一种化工原料,可以制备一系列物质(如下图所示)。下列说法正确的是

A.由氯化钠制备纯碱的过程中,利用了物质溶解度的差异
B.用Cl2制备漂白粉时,是将Cl2通入澄清石灰水中
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.图示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如图。
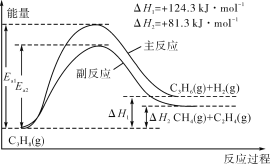
(1)丙烷脱氢制丙烯为强吸热过程。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)__(填“增大”“减小”或“不变”,下同),转化率α(C3H8)__。
②温度升高,副反应更容易发生的主要原因是__。
(2)如图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为104Pa和105Pa)。

①104Pa时,图中表示丙烯的曲线是__(填“Ⅰ”“Ⅱ”“Ⅲ”或“Ⅳ”)。
②104Pa、500℃时,主反应用平衡分压代替平衡浓度表示的化学平衡常数Kp=__(已知:气体分压=气体总压×体积分数)。
(3)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图。

已知:CO和H2的燃烧热分别为-283.0kJ·mol-1、-285.8kJ·mol-1。
①图中催化剂为__。
②298K时,该工艺总反应的热化学方程式为__。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人工固氮最重要的途径,反应的热化学方程式如下:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1。
2NH3(g) ΔH=-92.4kJ·mol-1。
(1)工业上有利于提高合成氨产率的条件有___。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)关于合成氨的说法,正确的是__。
A.合成氨反应的ΔH和ΔS都小于零
B.控制在773K下反应,目的是加快反应速率和提高平衡转化率
C.将NH3液化后移去,利于反应速率提高和平衡正向移动
D.原料气须经过净化处理,以防止催化剂中毒和事故发生
(3)若N2、H2的初始投入量分别为0.1mol、0.3mol,在恒容容器中反应,平衡后混合物中氨的体积分数(ψ)与温度、压强的关系如图所示。
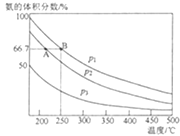
①比较p2、p3的大小:p2__p3(填“>”“<”或“=”),其原因是__。
②比较平衡时A、B点对应的化学反应速率:VA(N2)__VB(N2)(填“>”“<”或“=”)。
③若起始压强为1×108Pa,则平衡时B点的压强为___Pa。
(4)科学家发现,以H2O和N2为原料,熔融NaOH-KOH为电解质,纳米Fe2O3作催化剂,在250℃和常压下可实现电化学合成氨,阴极区发生的变化可按两步进行。已知第一步的反应为:Fe2O3+6e-+3H2O=2Fe+6OH-,则第二步的反应方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的表示方法多种多样,下面是用不同方法表示的几种有机物:
① ②
②![]() ③
③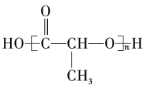 ④
④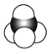
⑤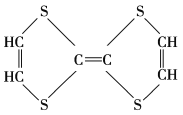 ⑥
⑥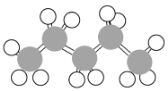
⑦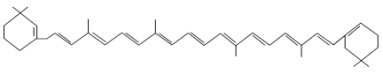
⑧
(1)上述表示方法中属于结构简式的为______(填序号,下同);属于结构式的为______;属于键线式的为______;属于比例模型的为______;属于球棍模型的为______。
(2)写出⑧中所含官能团的电子式:______、______。
(3)①的分子式为______,最简式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com