
在25℃、1×105Pa时,等质量的H2、Cl2、CO2、C2H2四种气体中( )
A. H2分子数最大 B. C2H2原子数最大
C. CO2密度最大 D. Cl2分子间平均距离最大
A
【解析】
试题分析:气体的相对分子质量分别是:H2是2;C2H2是26;CO2是44;Cl2是71.A.n=m÷M.气体的摩尔质量在数值上等于气体的相对分子质量。所以气体相对分子质量越大,该气体的摩尔质量就越大。因为气体是质量相同,所以相对分子质量最小的H2分子数最多。正确。B.假设气体的质量为m,在各种气体中含有的原子个数分别是:H2 :(m÷2)×2=m; C2H2: (m÷26)×4=2m/13; CO2: (m÷44)×3=3m/44; Cl2: (m÷71)×2=2m/71;可见原子数目最大的是H2。错误。C. 气体密度=m÷V=M÷Vm.可见在相同的条件下,气体的相对分子质量越大,气体的密度最大。在这四种气体中相对分子质量最大的是Cl2,所以Cl2密度最大。错误。由于外界条件相同,所以气体的分子间的距离就几乎完全相同。由于H2本身体积小,分子间作用力小,所以分子间平均距离最大的应该为H2。错误。
考点:考查气体在相同外界条件的各种性质的比较的知识。


科目:高中化学 来源:2013-2014辽宁省高三仿真测试理科综合化学试卷(解析版) 题型:填空题
对某芳香烃A分析结果如下:质谱图显示其最大质荷比为120,红外光谱显示其有两个甲基,核磁共振氢谱显示有五种峰且其面积比为1:2:2:1:6,A在有机合成中能发生如下转化:
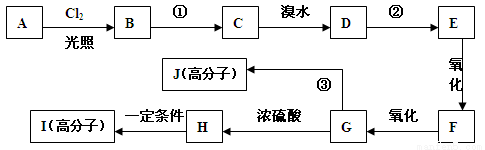
(已知:烃基发生取代反应的活性次序为 CH > CH2 > CH3 即叔氢>仲氢>伯氢)
回答以下问题:
(1)写出A的结构简式 ;
(2) 反应①和②相同的反应试剂和条件为 ;
(3)F分子中的含氧官能团名称是 ;
(4)反应③的化学方程式为: ;
(5)写出满足下列条件的H分子的所有同分异构体的结构简式:
①含有苯环 ②1 mol有机物发生银镜反应生成4 mol Ag ③苯环上的一溴代物有两种
;
(6)与H具有相同官能团的H的同分异构体有四种,其中一种分子K还存在顺反异构
体,试写出K的结构简式: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建龙岩市毕业联合考试理综化学试卷(解析版) 题型:填空题
(16分)辉铜矿是冶炼铜的重要原料。
(1)工业上冶炼粗铜的某种反应为:Cu2S+O2=2Cu+SO2
①当产生标况下11.2L气体时,转移电子数目为 ;
②将粗铜进行电解精炼,粗铜应与外电源的 极相接;若精炼某种仅含杂质锌的粗铜,通电一段时间后测得阴极增重ag,电解质溶液增重bg,则粗铜中含锌的质量分数为 ;
(2)将辉铜矿、软锰矿做如下处理,可以制得碱式碳酸铜:

①铜单质放置于潮湿空气中,容易生成碱式碳酸铜,反应化学方程式是 ;
②步骤Ⅱ中,碳酸氢铵参与反应的离子方程式为 ;
③步骤Ⅰ中发生如下3个反应,已知反应i)中生成的硫酸铁起催化作用。请写出反应iii)的化学方程式。
i)Fe2O3+3H2SO4 =Fe2(SO4)3+3H2O
ii) Cu2S+ Fe2(SO4)3 =CuSO4+CuS+2FeSO4
iii)
④步骤Ⅱ中调节pH后的溶液中,铜离子浓度最大不能超过 mol/L。
(已知Ksp[(Cu(OH)2)]=2×10-a)
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三高考模拟理综化学试卷(解析版) 题型:选择题
下列陈述中,Ⅰ、Ⅱ都正确且两者间具有因果关系的一组是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | FeCl3溶液能腐蚀Cu | Fe的金属性强于Cu |
B | Na2O2使酚酞溶液变红 | Na2O2是碱性氧化物 |
C | Cl2可部分与水反应 | 用排饱和食盐水法收集Cl2 |
D | 浓H2SO4可干燥NO和SO2 | NO和SO2还原性都弱 |
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州市高三5月综合练习理综化学试卷(解析版) 题型:选择题
常温下,向l00mL 0.01 mol?L-1 盐酸中逐滴加入0.02 mol?L-1 MOH溶液,如下图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中不正确的是( )
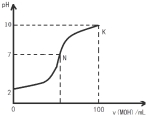
A.MOH是弱碱
B.N点c(Cl-) = c(M+)
C.随着MOH溶液的滴加,比值 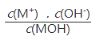 不变
不变
D.K点对应的溶液c(MOH)+c(OH-)-c(H+) = 0.005 mol?L-1
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县高二下学期期末考试化学试卷(解析版) 题型:填空题
(12分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
a |
|
| |||||||||||||||
b |
|
|
| c | d | e | f |
| |||||||||
g | h | i | j |
| k | l | m | ||||||||||
n |
|
|
|
|
| o | p |
|
|
|
|
|
|
|
|
|
|
试回答下列问题:
(1)元素p为26号元素,请写出其基态原子外围电子排布式: 。
(2)c与a形成6个原子组成分子结构简式: ,
该分子是: (填“极性”或“非极性”)分子。
(3)表中O、P两元素的部分电离能数据列于下表:
元 素 | O | P | |
电离能 kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态O2+再失去一个电子比气态P2+再失去一个电子难。对此,你的解释是 ;
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
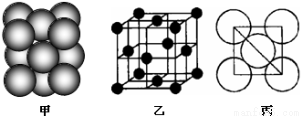
晶胞中i原子的配位数为 ,一个晶胞中i原子的数目为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县高二下学期期末考试化学试卷(解析版) 题型:选择题
下列变化或数据与氢键无关的是( )
A.甲酸蒸气的密度在373K时为1.335g·L-1,在293K时为2.5 g·L-1
B.氨分子与水分子形成一水合氨
C.水结冰体积增大。
D.SbH3的沸点比PH3高
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县第二学期期中考试高一化学试卷(解析版) 题型:实验题
用图1所示的Ⅰ和Ⅱ装置组合与Ⅰ和Ⅲ装置组合可以进行相关实验(夹持仪器省略),回答下列问题:
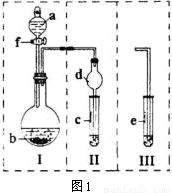
(1)若用Ⅰ和Ⅱ装置或Ⅰ和Ⅲ装置组合,实验前须检验 。
(2)在Ⅰ和Ⅱ装置组合中,若a为浓硫酸,b为铜粉,c容器中盛放品红溶液,旋开f后,给烧瓶加热,一段时间后c中的现象是 写出烧瓶中发生反应的化学方程式
(3)在Ⅰ装置中,若a为浓氨水,b为生石灰,欲制取氨气并证明氨水有碱性,最好应选用 (填“Ⅱ”或“Ⅲ”)装置与其组合,原因是
(4)在Ⅰ装置中,若a为可能含有Mg2+、Cu2+、Al3+、Fe3+四种阳离子的水溶液,b为过氧化钠固体,旋开f后,有白色沉淀产生并放出氧气,过氧化钠固体的物质的量与产生沉淀的质量关系如图2,则a溶液中含有的阳离子有 。(写化学式)
(5)在图2中A→B段反应过程中溶液所增加的阴离子是 (写化学式)

查看答案和解析>>
科目:高中化学 来源:2013-2014福建省漳州市八校高三第四次联考理综化学试卷(解析版) 题型:简答题
(13分)近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致。钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3
(1)铬元素的基态原子的价电子层排布式是 。
(2)C元素与其同主族下一周期元素组成的晶体中,C原子的杂化方式为 .
(3)Mn和Fe的部分电离能数据如表:
元 素 | Mn | Fe | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
根据表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(4)镍(Ni)可形成多种配合物,且各种配合物有广泛的用途。
某镍配合物结构如右图所示,分子内含有的作用力
有 (填序号)。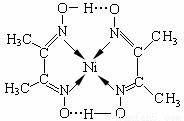
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
组成该配合物分子且同属第二周期元素的电负性由大到小的顺序是 。
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是
(6)铁能与氮形成一种磁性材料,其晶胞结构如右图所示,则该磁性材料的化学式为
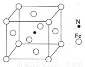
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com