
 pC����pH����ָ��ϡ��Һ���������ʵ���Ũ�ȵij��ö�����ֵ������Һ��ij���ʵ�Ũ��Ϊ��1��10����mol��L��1����pC=��lg��1��10������=3��H2CO3��Һ��pC-pH��ϵ��ͼ��
pC����pH����ָ��ϡ��Һ���������ʵ���Ũ�ȵij��ö�����ֵ������Һ��ij���ʵ�Ũ��Ϊ��1��10����mol��L��1����pC=��lg��1��10������=3��H2CO3��Һ��pC-pH��ϵ��ͼ��
��ش��������⣺
��1��pH=2��4ʱ��H2CO3��Һ����Ҫ���ڵ�����Ϊ ��
��2����֪̼����Һ�д���ƽ��:H2O��CO2 H2CO3
H2CO3![]() H++HCO3��������ҺpH��5��С��0ʱ����Һ��H2CO3��pC���������ԭ����
H++HCO3��������ҺpH��5��С��0ʱ����Һ��H2CO3��pC���������ԭ����
��
��3���ܹ��ֿ�������������Ӱ�졢�������� pH�仯�������Һ����֮Ϊ������Һ����Ũ�Ⱦ�Ϊ0.1mol��L������NaHCO3��Na2CO3�����Һ����һ�ֻ�����Һ�����������������ƽ��HCO3�� H++CO32���ƶ�����Һ��H+Ũ�ȱ仯������������Ϣ�����в����γɻ�����Һ���� ��
H++CO32���ƶ�����Һ��H+Ũ�ȱ仯������������Ϣ�����в����γɻ�����Һ���� ��
A.̼���ƺ��������ƵĻ����Һ B.����ʹ����ƵĻ����Һ
C.����������ƵĻ����Һ D.��ˮ���Ȼ�淋Ļ����Һ

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 pC����pH����ָ��ϡ��Һ���������ʵ���Ũ�ȵij��ö�����ֵ����ij��Һ���ʵ�Ũ��Ϊ1��10-3mol/L������Һ�и����ʵ�pC=-lg10-3=3����֪H2CO3��Һ�д�������ƽ�⣺
pC����pH����ָ��ϡ��Һ���������ʵ���Ũ�ȵij��ö�����ֵ����ij��Һ���ʵ�Ũ��Ϊ1��10-3mol/L������Һ�и����ʵ�pC=-lg10-3=3����֪H2CO3��Һ�д�������ƽ�⣺| O | - 3 |
| O | - 3 |
| O | 2- 3 |
| O | - 3 |
| O | 2- 3 |
| O | 2- 3 |
| O | - 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| 1 |
| 2 |
| ʱ��/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c��NH3��/��mol?L-1�� | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
 �������£��÷�Ӧ�ﵽ��ѧƽ��ʱ��������Ũ��Ϊ
�������£��÷�Ӧ�ﵽ��ѧƽ��ʱ��������Ũ��Ϊ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
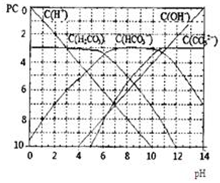 pC����pH����ָ��ϡ��Һ�У��������ʵ���Ũ�ȵij��ö�����ֵ����ij��Һ���ʵ�Ũ��Ϊ��1��10-3mol/L�������Һ�����ʵ�pC=-lg1��10-3=3��ͼΪH2CO3�ڼ���ǿ���ǿ����Һ��ƽ��ʱ��Һ�����ֳɷֵ�pC-pHͼ����ش��������⣺
pC����pH����ָ��ϡ��Һ�У��������ʵ���Ũ�ȵij��ö�����ֵ����ij��Һ���ʵ�Ũ��Ϊ��1��10-3mol/L�������Һ�����ʵ�pC=-lg1��10-3=3��ͼΪH2CO3�ڼ���ǿ���ǿ����Һ��ƽ��ʱ��Һ�����ֳɷֵ�pC-pHͼ����ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ij�¶����κε���ʵ�ˮ��Һ�У�pC��H+��+pC��OH-��=14 | B��0.01mol/L��CaCl2��Һ���μӴ�����Һ���μӹ�����pC��Ca2+����С | C����0.01mol/L������ζ�ijŨ�ȵ�NaOH��Һ���ζ�������pC��H+�������� | D��ij�¶��£�AB���������ӻ������Ksp=1.0��10-10���䱥����Һ��pC��A+��+pC��B-��=10 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com