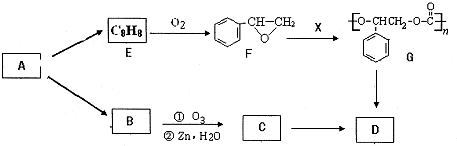
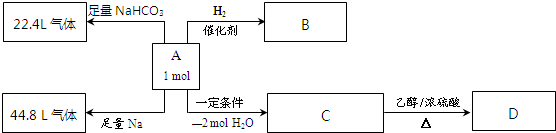
氨与硝酸在工农业生产中均有重要的用途.某小组根据工业生产原理设计了生产氨与硝酸的主要过程如下:
(1)以N
2和H
2为原料合成氨气.反应N
2(g)+3H
2(g)?2NH
3(g)△H<0
①一定温度下,在密闭容器中充入1mol N
2和3mol H
2发生反应.若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的
,则N
2的转化率α=
;若此时放出热量为a KJ,则其热化学方程式为
.
②氨气溶于水则为氨水.已知NH
3?H
2O的电离平衡常数为Kb,计算0.1mol/L的NH
3?H
2O溶液中c(OH
-)=
mol/L(设平衡时NH
3?H
2O的浓度约为0.1mol/L,用含有Kb的代数式表示).
③合成氨的原料气H
2可来自CH
4的综合利用:CH
4+H
2O═CO+3H
2.将CH
4设计成燃料电池,其利用率更高,装置示意如图一(A、B为多孔性石墨棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.44.8L<V≤89.6L时,负极电极反应为
.
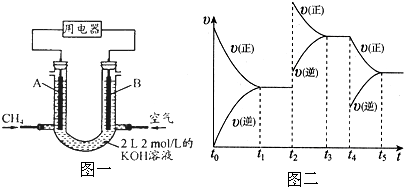
(2)以氨气、空气为主要原料先进行氨的催化氧化,然后制得硝酸.
①其中NO在容积恒定的密闭容器中进行反应:2NO(g)+O
2(g)?2NO
2(g)△H>0
该反应的反应速率(v)随时间(t)变化的关系如图二所示.若t
2、t
4时刻只改变一个条件,下列说法正确的是(填选项序号)
.
a.在t
1~t
2时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
b.在t
2时,采取的措施可以是升高温度
c.在t
3~t
4时与在t
1~t
2时的平衡常数K肯定相同
d.在t
5时,容器内NO
2的体积分数是整个过程中的最大值
②实际上,生成的NO
2会聚合生成N
2O
4.如果在一密闭容器中,17℃、1.01×10
5Pa条件下,2NO
2(g)?N
2O
4(g)△H<0的平衡常数K=13.3.若改变上述体系的某个条件,达到新的平衡后,测得混合气体中c(NO
2)=0.04mol/L,c(N
2O
4)=0.007mol/L,则改变的条件是
.
③硝酸厂常用如下方法处理尾气用Na
2CO
3溶液吸收NO
2生成CO
2.若每9.2g NO
2和Na
2CO
3溶液反应时转移电子数为0.1mol,则反应的离子方程式是
.




 科学实验活动册系列答案
科学实验活动册系列答案