
 完成下列问题:
完成下列问题:| 实验编号 | 待测盐酸溶液的体积/mL | 滴入NaOH溶液的体积/mL |
| 1 | 20.00 | 23.00 |
| 2 | 20.00 | 23.10 |
| 3 | 20.00 | 22.90 |
分析 (1)①由图可知,甲有活塞,为酸式滴定管,可用于盛装酸性溶液;
②消耗NaOH为$\frac{23.00+22.90+23.10}{3}$=23.00mL,结合c(酸)V(酸)=c(NaOH)V(NaOH)计算;
(2)用酚酞作指示剂,开始为无色,滴定终点时变为粉红色;
(3)由c(酸)V(酸)=c(NaOH)V(NaOH)可知,不当操作使V(NaOH)偏大,则测定结果偏高,以此来解答.
解答 解:(1)①由图可知,甲有活塞,为酸式滴定管,用甲滴定管盛待测定的未知浓度的盐酸溶液,故答案为:甲;
②消耗NaOH为$\frac{23.00+22.90+23.10}{3}$=23.00mL,c(酸)=$\frac{0.023L×0.8mol/L}{0.02L}$=0.92 mol/L,故答案为:0.92 mol/L;
(2)若用酚酞作指示剂,开始为无色,滴定终点时变为粉红色达到滴定终点的标志是无色变粉红色且30 s不变色,
故答案为:无色变粉红色且30 s不变色;
(3)A.盛装待测液的锥形瓶用水洗后未干燥,对实验无影响,故A不选;
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失,V(NaOH)偏大,则测定结果偏高,故B选;
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗,消耗V(NaOH)偏大,则测定结果偏高,故C选;
D.读碱式滴定管的读数时,滴定前仰视凹液面最低处,滴定后俯视读数,V(NaOH)偏小,则测定结果偏低,故D不选;
故答案为:BC.
点评 本题考查中和滴定,为高频考点,把握仪器的使用、滴定原理、数据处理及误差分析为解答的关键,侧重分析与实验能力的考查,注意结合计算式分析误差,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$ | B. | OH-的物质的量 | ||
| C. | c(H+)×c(OH-) | D. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$、 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2具有很强的氧化性,在化学反应中只能作氧化剂 | |
| B. | 35Cl、37Cl为不同的核素,有不同的化学性质 | |
| C. | 实验室制备Cl2,不宜用排水法收集 | |
| D. | 铁丝在氯气燃烧生成氯化亚铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 普通锌锰干电池中的MnO2在工作时起催化作用 | |
| B. | lmol Na2O2与足量水反应产生O2,理论上转移的电子数约为2×6.02×1023 | |
| C. | 室温下,体积、pH均相同的HA和HB两种一元酸分别与足量的锌反应,HA放出氢气多,说明酸性:HB>HA | |
| D. | 恒温恒压密闭容器中反应N2(g)+3H2(g)?2NH3(g)△H=-a kJ•mol-1达到平衡时,向容器中再充入一定量NH3,重新达平衡时a值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-的物质的量浓度为2mol/L | |
| B. | CaCl2的物质的量为1mol | |
| C. | 取出50 mL后,剩余溶液中CaCl2的物质的量浓度为0.5mol/L | |
| D. | 该溶液中水的体积为100 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
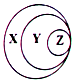
| A. | X-胶体 Y-混合物 Z-淀粉溶液 | B. | X-化合物 Y-含氧酸盐 Z-氯化钠 | ||
| C. | X-气态氢化物 Y-酸 Z-盐酸 | D. | X-强电解质 Y-强酸 Z-硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13:8:27 | B. | 13:9:27 | C. | 26:16:27 | D. | 286:8:27 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=3和pH=5的盐酸各10mL混合,所得溶液的pH=4 | |
| B. | 当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数 | |
| C. | 液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质 | |
| D. | 溶液中c(H+)越大,pH也越大,溶液的酸性就越强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com