
一定条件下发生反应:2KClO3+I2=2KIO3+Cl2,则下列相应的结论,不正确的是
A.反应中氧化剂是KClO3 B.单质的还原性:I2> Cl2
C.元素的非金属性:I>Cl D.KClO3中的Cl在反应中得电子
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| 太阳光 |
| 高温 |
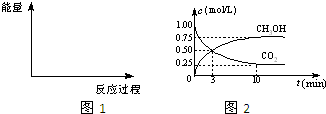
| n(CH3OH) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
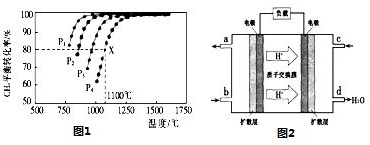
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| CH3OH |
| ||
| H+ |

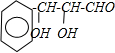
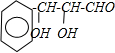
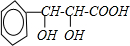
| 浓H2SO4 |
| △ |
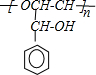
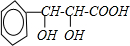
| 浓H2SO4 |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.34 | B、0.64 | C、0.44 | D、0.54 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com