
| A. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO${\;}_{4}^{2-}$沉淀完全2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| B. | 铝溶于氢氧化钠溶液:Al+2OH-+H2O═AlO2-+H2↑ | |
| C. | 玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-═Na2SiO3↓+H2O | |
| D. | VO2+与酸性高锰酸钾溶液反应:5VO2++MnO${\;}_{4}^{-}$+H2O═5VO${\;}_{2}^{+}$+Mn2++2H+ |
分析 A.硫酸根离子恰好沉淀时,铝离子与氢氧根离子的物质的量之比为1:4,二者反应生成偏铝酸根离子;
B.2mol铝完全反应生成3mol氢气,该反应不满足电子守恒;
C.硅酸钠为易溶的强电解质,离子方程式中应该拆开;
D.VO2+与酸性高锰酸钾溶液发生氧化还原反应生成VO2+.
解答 解:A.明矾[KAl(SO4)2]溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀,硫酸铝钾与氢氧化钡的物质的量之比为1:2,反应生成偏铝酸钠,正确的离子方程式为:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,故A错误;
B.铝溶于氢氧化钠溶液,反应生成偏铝酸钠和氢气,正确的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故B错误;
C.玻璃试剂瓶被烧碱溶液腐蚀,硅酸钠应该拆开,正确的离子方程式为:SiO2+2OH-═SiO32-+H2O,故C错误;
D.VO2+与酸性高锰酸钾溶液反应,二者发生氧化还原反应生成VO2+,的离子方程式为:5VO2++MnO4-+H2O═5VO2++Mn2++2H+,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,题目难度中等,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题

| A. | 洗气瓶中产生的沉淀是碳酸钡 | |
| B. | 洗气瓶中产生的沉淀是硫酸钡 | |
| C. | 在Z导管出来的气体中无二氧化碳 | |
| D. | 反应一段时间后洗气瓶中溶液的酸性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 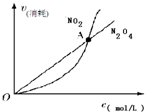 表示在恒容密闭容器中,恒温条件下发生的可逆反应2NO2(g)?N2O4(g),各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| B. | 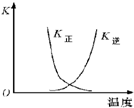 曲线表示反应2A(g)+B(g)?2C(g)△H>0,正、逆反应的平衡常数K随温度的变化 | |
| C. | 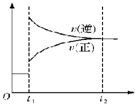 表示对反应2X(g)+Y(g)?Z(s)+3W(g)△H<0 在t1时刻增大压强 | |
| D. | 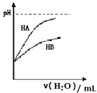 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液pH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 | 现象 | 结论及解释 |
 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
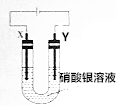 X、Y均为石墨电极,电解硝酸银溶液,实验装置如图所示,电解实验过程中,发现Y极增重的同时,Y极负极产生气泡且气泡由无色变红棕色.已知电流效率等于生成目标产物消耗电子书与电路转移总电子数之比.下列推断正确的是( )
X、Y均为石墨电极,电解硝酸银溶液,实验装置如图所示,电解实验过程中,发现Y极增重的同时,Y极负极产生气泡且气泡由无色变红棕色.已知电流效率等于生成目标产物消耗电子书与电路转移总电子数之比.下列推断正确的是( )| A. | Y极附近产生的无色气泡是H2 | |
| B. | X极附近电解质溶液中c(H+)会减小 | |
| C. | 若产生2.24L O2(标准状况下)时析出32.4g银,则电流效率为80% | |
| D. | 阴极的副反应为NO3-+3e-+4H+═NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氧化性:A2>B2>C2>D2 | B. | 还原性:C->A->B->D- | ||
| C. | 2A-+D2═2D-+A2的反应能进行 | D. | 2C-+B2═2B-+C2的反应不能进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com