
(Ⅰ)配平下列氧化还原反应方程式:
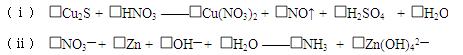
(Ⅱ)某温度时,在容积为2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,根据图中数据,试回答:
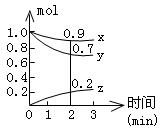
(1)计算反应开始2min内的![]() = ,
= , ![]() = ,
= ,![]() = ,
= ,
(2)容器内的反应物是 。
(3)写出该反应的化学方程式 。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
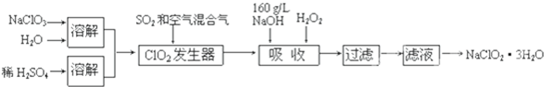
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2015届广西毕节燕中高一下学期期末考试化学试卷(解析版) 题型:填空题
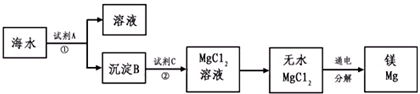
1808年,英国化学家戴维用钾还原氧化镁,最早制得少量的镁。镁是航空工业的重要材料,镁合金用于制造飞机机身、发动机零件等,一架超音速飞机约有5%的镁合金构件,一枚导弹一般消耗100~200公斤镁合金;镁作为一种强还原剂,还用于钛、锆、铍和铀等的生产中;镁是燃烧弹和照明弹不能缺少的组成物;镁粉是节日烟花必需的原料。镁及其合金是一种用途很广泛的金属材料,目前世界上60%的镁是从海水中提取的。从海水(主要含NaCl和MgSO4)中提取金属镁的主要步骤如下:
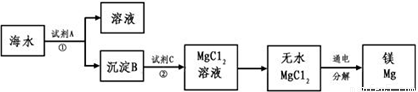
回答下列问题:
(1)Mg在周期表中的位置______________________,试剂A可以选用_____________________,试剂C可选用_______________________;
(2)步骤①的离子方程式_________________________________________;
(3)用电子式表示氯化镁的形成过程_______________________________;
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为:_____________________________________________________;
(5)戴维制镁的化学方程式为_____________________________________;
(6)配平下列反应的方程式。
① 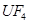 +
+ 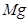 ——
——
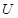 +
+ 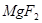
② 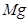 +
+ 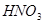 ——
——
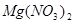 +
+ 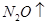 +
+

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com