
| A. | 浓硫酸滴在纸上使纸变黑,是由于浓硫酸有脱水性 | |
| B. | 稀释浓硫酸时,应将水沿器壁慢慢注入浓硫酸中,并不断用玻璃棒搅拌 | |
| C. | 欲除去CO2中的水蒸气,可将气体通过盛有浓硫酸的洗气瓶 | |
| D. | 不慎在皮肤上沾上少量浓硫酸时,应立即用大量水冲洗 |
分析 A、浓硫酸滴在纸上,纸变黑,与其脱水性有关;
B、根据稀释浓硫酸会放热进行解答;
C、浓硫具有吸水性,而与二氧化碳不反应;
D、少量浓硫酸时沾上皮肤上,应立即用大量水冲洗.
解答 解:A、浓硫酸滴在纸上,纸变黑,是由于浓硫酸有脱水性,故A正确;
B、稀释浓硫酸会放热,所以稀释浓硫酸时应将浓硫酸沿器壁慢慢注入水中,并不断搅拌,故B错误;
C、浓硫具有吸水性,而与二氧化碳不反应,所以欲除去CO2中的水蒸气,可将气体通过盛有浓硫酸的洗气瓶,故C正确;
D、少量浓硫酸时沾上皮肤上,应立即用大量水冲洗,故D正确;
故选B.
点评 本题考查化学实验安全及事故的处理,题目难度不大,注意相关实验基本操作知识的积累.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ①②④ | C. | ③⑤⑥ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
.原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cl2参加反应转移电子数一定为2NA | |
| B. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA | |
| C. | 根据反应中HNO3(稀)$\stackrel{被还原}{→}$NO,而HNO3(浓)$\stackrel{被还原}{→}$NO2可知,氧化性HNO3(稀)>HNO3(浓) | |
| D. | 含有大量NO3-的溶液中,不能同时大量存在H+、Fe2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径比钙小 | |
| B. | 最高价氧化物为SeO3 | |
| C. | H2Se一定是强酸 | |
| D. | 气态氢化物为H2Se,稳定性比H2S 弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

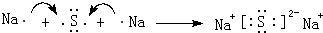 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com