
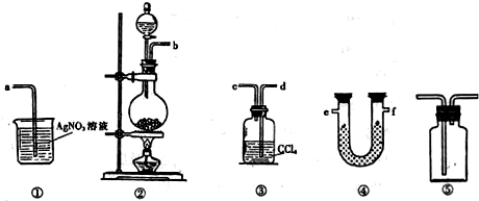
分析 (1)装置②中是二氧化锰和浓盐酸发生反应生成氯化锰、氯气和水,减缓氯化氢挥发可以逐滴滴入,缓慢加热等;
(2)根据实验原理和目的及各装置的作用决定仪器排列组装顺序,U形管中所盛试剂作用是检验水蒸气的存在,实验室常用无水硫酸铜检验水的存在,装置③除去氯气,防止HCl干扰检验;
(3)①装置用来检验HCl气体,为了确保实验结论的可靠性,应排除氯气的干扰,故应检验氯气是否除尽,检验氯气通常用湿润的KI淀粉试纸(或湿润的有色布条);
(4)HCl呈酸性,使紫色石蕊试液变红,Cl2使紫色石蕊试液先变红后褪色.
解答 解:(1)装置②中是二氧化锰和浓盐酸发生反应生成氯化锰、氯气和水,反应的化学方程式为:反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,为减少HCl挥发应采取的操作措施逐滴加入,缓慢加热减少氯化氢挥发,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;逐滴滴入浓盐酸,缓慢加热等;
(2)先验证制备的氯气中是否含有水蒸气,然后除去氯气,再检验是否含有氯化氢,所以相应的装置接口连接顺序为b,e,f,d,c,a,无水硫酸铜与水反应生成蓝色五水硫酸铜晶体,可用来检验水,氯气易溶于四氯化碳溶液,可用来吸收氯气,防止HCl干扰检验,
故答案为:e;f;d;c;无水CuSO4;吸收氯气;
(3)①装置用来检验HCl气体,为了确保实验结论的可靠性,应排除氯气的干扰,在③吸收氯气之后要检验氯气是否完全除去,根据氯气具有强氧化性的性质,可用湿润的淀粉KI试纸检验,如不变色,说明已经完全除去,
故答案为:①③;湿润的淀粉KI试纸(或湿润的有色布条);
(4)HCl呈酸性,使紫色石蕊试液变红,Cl2使紫色石蕊试液先变红后褪色.若只变红不褪色,说明制Cl2时有HCl挥发出来.
故答案为:紫色石蕊试液; 紫色石蕊溶液变红且不褪色.
点评 本题以氯气的制备和性质的检验为载体,考查学生对实验方案设计评价,题目综合性较强合,难度中等.关键理清实验原理和目的及各装置的作用.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水,将湿润的红色石蕊试纸放在试管口 | |
| B. | 加氢氧化钠溶液,加热,滴入紫色石蕊试剂 | |
| C. | 加氢氧化钠溶液,加热,滴入酚酞试剂 | |
| D. | 加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化氢有“绿色氧化剂”之称,故过氧化氢只能作氧化剂 | |
| B. | 氯气常用于自来水的杀菌消毒,其中起杀菌消毒作用的是氯气 | |
| C. | 过氧乙酸(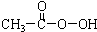 )分子中既有极性键又有非极性键 )分子中既有极性键又有非极性键 | |
| D. | 4.8g臭氧与3.36L氧气含有的原子总数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 神舟飞船所用太阳能电池板可将光能转换为电能,所用转换材料是单晶硅 | |
| B. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| C. | 乙醇和汽油都是可再生能源,应大力推广使用乙醇汽油 | |
| D. | “辽宁舰”上用于舰载机降落的拦阻索是一种特种钢缆,属新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量的H2SO4溶液 | B. | 加入少量NaCl溶液 | ||
| C. | 加热 | D. | 加入少量NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com