
科目:高中化学 来源: 题型:解答题
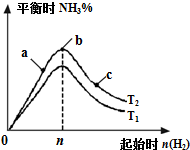 某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol 反应的影响,实验结果可表示成如图所示的规律(T表示温度,n表示物质的量):
某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol 反应的影响,实验结果可表示成如图所示的规律(T表示温度,n表示物质的量):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1000ωνρ}{36.5}$mol/L | B. | $\frac{1000νρ}{36.5+22400}$mol/L | ||
| C. | $\frac{ων}{22.4(V+1)}$mol/L | D. | $\frac{1000νρ}{36.5V+22400}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
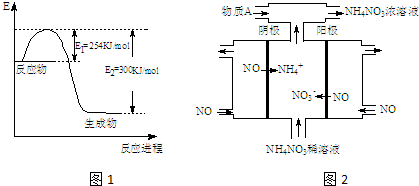
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
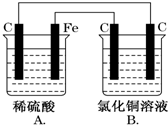 烧杯A中盛放0.1mol•L-1的H2SO4溶液,烧杯B中盛放0.1mol•L-1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( )
烧杯A中盛放0.1mol•L-1的H2SO4溶液,烧杯B中盛放0.1mol•L-1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( )| A. | A为原电池,B为电解池 | |
| B. | A中阳离子向碳极移动,阴离子向铁极移动 | |
| C. | 当A烧杯中产生0.1 mol气体时,B烧杯中产生气体的物质的量也为0.1 mol | |
| D. | 一段时间后,B烧杯中溶液的浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 使用催化剂 | C. | 降低温度 | D. | 缩小容器体积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com