

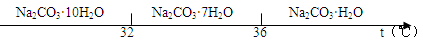



科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO |
| B | 向某溶液中加入2滴KSCN溶液,溶液不显血红色。再向溶液中加入几滴新制的氯水,溶液变为血红色 | 该溶液中一定含有Fe2+ |
| C | 某气体能使湿润的蓝色石蕊试纸变红 | 该气体水溶液一定显碱性 |
| D | 将少量某有机物滴加到新制氢氧化铜悬浊液中,充分振荡,未见砖红色沉淀生成 | 该有机物不含醛基 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.盐酸 | B.Na2CO3溶液 |
| C.氯水 | D.FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一定没有N2,CO和HCl中至少有一种 |
| B.一定没有N2,CO和HCl都有 |
| C.一定有N2,CO和HCl中至少有一种 |
| D.一定有N2和HCl,肯定没有CO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | 开始沉淀的pH | 沉淀完全的pH | 沉淀溶解的pH |
| Cu2+ | 4.4 | 6.4 | |
| Al3+ | 3.0 | 5.0 | 10 |
| Zn2+ | 5.9 | 8.9 | 11 |
查看答案和解析>>
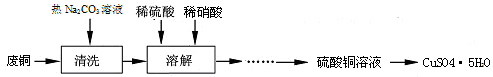
科目:高中化学 来源:不详 题型:填空题
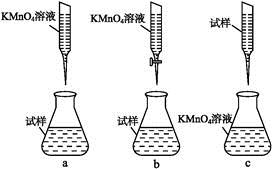
查看答案和解析>>
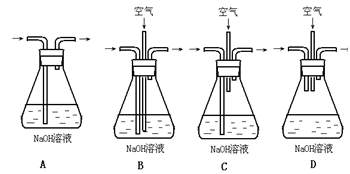
科目:高中化学 来源:不详 题型:单选题
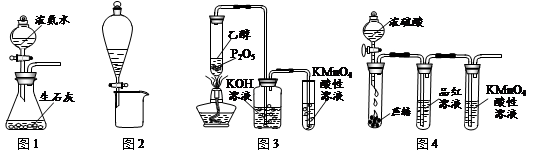
| A.用图1所示装置可制取氨气 |
| B.用图2所示装置可分离CH3CH2OH和CH3COOC2H5混合液 |
| C.用图3所示装置可制取乙烯并验证其易被氧化 |
| D.用图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
查看答案和解析>>
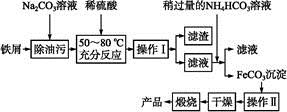
科目:高中化学 来源:不详 题型:单选题
| 选项 | A | B | C | D |
| 实验 目的 | 除去KCl中少量MnO2 | 用10 mol·L-1盐酸配制100 mL 0.1 mol·L-1盐酸 | 用含有少量NH4Cl杂质的NaCl溶液制备氯化钠晶体 | 除去乙烯中少量SO2 |
| 实验仪器或装置 | 烧杯、玻璃棒、分液漏斗 | 100 mL容量瓶、玻璃棒、烧杯 |  | 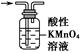 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.FeCl3溶液得到FeCl3固体——加热蒸干 |
| B.除去Cu粉中混有的CuO——加入稀硝酸溶解、过滤、洗涤、干燥 |
| C.分离NaNO3和BaSO4的混合物——溶解、过滤 |
| D.除去NaOH溶液中混有的少量Na2SO4——加入BaCl2溶液、过滤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com