
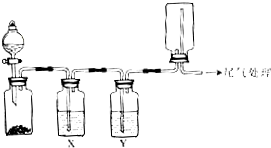
 利用下图装置可以进行实验并能达到实验目的是( )
利用下图装置可以进行实验并能达到实验目的是( )| 选项 | 实验目的 | 试剂X | 试剂Y |
| A | Na2SO3和盐酸制取并收集纯净干燥的SO2 | 饱和NaHSO3溶液 | 浓硫酸 |
| B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
| C | 苯与浓溴水在铁催化下反应制溴苯并收集HBr | CCl4 | 浓硫酸 |
| D | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.用亚硫酸氢钠溶液除去杂质氯化氢,然后用浓硫酸干燥二氧化硫,二氧化硫的密度大于空气,可用排空气法收集;
B.NO与空气中氧气反应,不能使用排空气法收集;
C.浓硫酸能够氧化HBr,不能使用浓硫酸干燥HBr;
D.二氧化锰与浓盐酸反应制备氯气时,需要在加热条件下进行.
解答 解:A.Na2SO3和盐酸制取并收集纯净干燥的SO2,二氧化硫中含有HCl,可用饱和NaHSO3溶液除去zazHCl,然后用浓硫酸干燥二氧化硫,最后利用向下排空气法收集,图示装置能够达到实验目的,故A正确;
B.由于NO与氧气反应生成二氧化氮,收集NO时应该用排水法,不能使用排空气法,故B错误;
C.浓硫酸具有强氧化性,能够将HBr氧化,不能使用浓硫酸干燥HBr,故C错误;
D.图示装置制取的气体不需要加热,而浓盐酸与二氧化锰的反应需要加热,所以无法达到实验目的,故D错误;
故选A.
点评 本题考查了化学实验方案的设计与评价,题目难度中等,涉及常见气体的制备原理及干燥、收集方法,明确常见气体的性质及制备方法为解答关键,试题培养了学生的化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

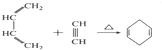
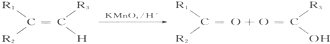
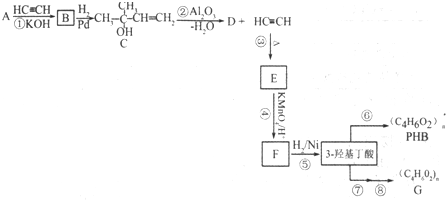
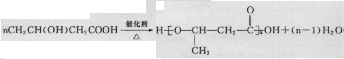
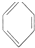 B.
B.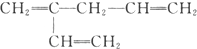 C.
C.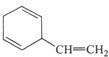 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.
 ,该化合物是由极性(填“极性”“非极性”)键形成的.
,该化合物是由极性(填“极性”“非极性”)键形成的.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
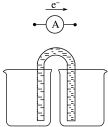 下面是18×7的格子,按要求作答
下面是18×7的格子,按要求作答| A | He | ||||||||||||||||
| G | C | D | |||||||||||||||
| B | E | F | I | H | |||||||||||||
| Fe | Cu | ||||||||||||||||
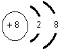 ,C、D、E、F的简单离子半径由小到大顺序是Al3+<Mg2+<F-<O2-.(填写离子符号 )
,C、D、E、F的简单离子半径由小到大顺序是Al3+<Mg2+<F-<O2-.(填写离子符号 )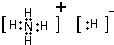 (填电子式).
(填电子式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ | 溶解性 | 挥发性 | 化学性质 |
| 无水乙醇 | -114.1 | 78.3 | 能与水以任意比互溶 | 易挥发 | 能使酸性高锰酸钾溶液褪色 |
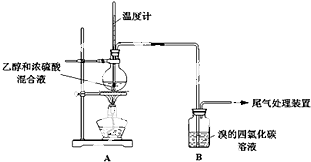
| 操 作 | 现 象 |
| 点燃酒精灯,加热至170℃ | I:A中烧瓶内液体渐渐变黑 II:B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕,清洗烧瓶 | III:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
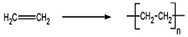 ,加聚反应.
,加聚反应.| 设 计 | 现 象 |
与A连接的装置如下: | C中溶液褪色,加热后又恢复红色; F中溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
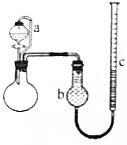 某研究性学习小组为了测定镀锌薄铁板(假设只含Fe和Zn)中锌的质量分数ω(Zn),用如图所示装置(夹持装置略去)进行实验,通过测定产生H2的体积计算ω(Zn).已知:①锌易溶于强碱溶液,发生反应为Zn+2NaOH═Na2ZnO2+H2↑.②所用的镀锌薄铁板均为m1g.回答下列问题:
某研究性学习小组为了测定镀锌薄铁板(假设只含Fe和Zn)中锌的质量分数ω(Zn),用如图所示装置(夹持装置略去)进行实验,通过测定产生H2的体积计算ω(Zn).已知:①锌易溶于强碱溶液,发生反应为Zn+2NaOH═Na2ZnO2+H2↑.②所用的镀锌薄铁板均为m1g.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
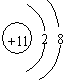 .
. ,所含的化学键类型为离子键、共价键.
,所含的化学键类型为离子键、共价键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com