

分析 向盐卤溶液中加入NaClO,NaClO具有强氧化性,能将Fe2+氧化为Fe3+,向盐卤中加入少量NaOH,NaOH和Fe3+反应生成Fe(OH)3,CO(NH2)2和NaClO发生氧化还原反应,生成物除盐外,都是能参与大气循环的物质,所以生成物是NaCl、CO2、N2、H2O,过量二氧化碳能和NaOH反应生成碳酸氢钠,将溶液过滤得到的滤渣是Fe(OH)3,滤液I中含有Mg2+、Cl-、Na+,将滤液I蒸发、结晶、过滤得到MgCl2•6H2O,则滤液中含有的杂质离子是Na+,直接将MgCl2•6H2O加强热能得到MgO,发生反应MgCl2•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgO+2HCl↑+5H2O↑,氯化镁易水解,所以不能用加热MgCl2•6H2O方法制取氯化镁,要在HCl氛围中制取氯化镁.
(1)根据盐卤的成份来看,加入NaClO能氧化Fe2+使它变成Fe(OH)3沉淀;滤液Ⅰ的成分为氯化镁、氯化钠,冷却结晶,得到氯化镁晶体,滤液的成分为氯化钠;
(2)根据NaClO与尿素CO(NH2)2反应时,依据元素守恒以及生参与大气循环的物质,可知生成物有NaCl,还有CO2、N2、H2O;
(3)氯化镁易水解,所以不能用加热MgCl2•6H2O方法制取氯化镁,要在HCl氛围中制取;
(4)SO2吸收Br2反应生成硫酸和HBr,SO2气体用氨水吸收生成(NH4)2SO3或NH4HSO3.
解答 解:(1)向盐卤溶液中加入NaClO,NaClO具有强氧化性,能将Fe2+氧化为Fe3+,向盐卤中加入少量NaOH,NaOH和Fe3+反应生成Fe(OH)3,滤渣是Fe(OH)3,滤液Ⅰ的成分为氯化镁、氯化钠,冷却结晶,得到氯化镁晶体,滤液的成分为氯化钠,所以滤液II中杂质离子是Na+,
故答案为:Fe(OH)3;Na+;
(2)NaClO与尿素CO(NH2)2反应时,生成物有NaCl,还有CO2、N2、H2O,则该反应的化学方程式为3NaClO+CO(NH2)2=3NaCl+CO2↑+N2↑+2H2O或NaOH+3NaClO+CO(NH2)2═3NaCl+NaHCO3+N2↑+2H2O,
故答案为:3NaClO+CO(NH2)2=3NaCl+CO2↑+N2↑+2H2O或NaOH+3NaClO+CO(NH2)2═3NaCl+NaHCO3+N2↑+2H2O;
(3)氯化镁易水解,加热MgCl2•6H2O生成的是Mg(OH)Cl或MgO,为防止氯化镁水解,在制取氯化镁时,要将MgCl2•6H2O放在氯化氢气体中,
故答案为:HCl气体;
(4)溴具有强氧化性,二氧化硫具有还原性,二者在水溶液里能发生氧化还原反应生成硫酸和氢溴酸,离子反应方程式为SO2+Br2+2H2O═4H++SO42-+2Br-
,当二氧化硫少量时,二者反应生成(NH4)2SO3,当二氧化硫过量时,二者反应生成NH4HSO3,
故答案为:SO2+Br2+2H2O═4H++SO42-+2Br-;(NH4)2SO3或NH4HSO3.
点评 本题考查了海水资源的开发和利用,从整体上把握流程图,知道每一步可能发生的反应、明确物质的性质是解本题关键,根据物质间的反应来分析解答,题目难度中等,培养了学生分析问题,运用信息的能力.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:选择题
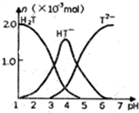 常温下,向10ml0.2mol•L-1草酸(用H2T表示)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的PH有如图关系,下列说法正确的是( )
常温下,向10ml0.2mol•L-1草酸(用H2T表示)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的PH有如图关系,下列说法正确的是( )| A. | HT-在溶液中水解程度大于电离程度 | |
| B. | 当V(NaOH)=10mL时,溶液中水的电离程度比纯水大 | |
| C. | 当V(NaOH)=15mL时,溶液中存在:c(Na+)>c(HT-)>c(T2-)>c(OH-)>c(H+) | |
| D. | 当V(NaOH)=20mL时,溶液中存在:c(OH-)=c(HT-)+2c(H2T)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
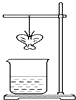 某同学用滤纸折成一个纸蝴蝶并喷洒一种溶液(保持湿润),挂在铁架台上.另取一只盛某种溶液的烧杯,放在纸蝴蝶的下方(如图).过一会,发现纸蝴蝶变为红色.如表的组合中,能够实现上述变化的是( )
某同学用滤纸折成一个纸蝴蝶并喷洒一种溶液(保持湿润),挂在铁架台上.另取一只盛某种溶液的烧杯,放在纸蝴蝶的下方(如图).过一会,发现纸蝴蝶变为红色.如表的组合中,能够实现上述变化的是( )| A | B | C | D | |
| 纸蝴蝶上的喷洒液 | 酚酞 | 酚酞 | 石蕊 | 石蕊 |
| 小烧杯中的溶液 | 浓氨水 | 浓NaOH | 浓盐酸 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量金属钠加到冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| B. | NaHCO3溶液中滴加少量Ca(OH)2溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 硫酸铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 将2 mol/L AlCl3溶液和7 mol/L NaOH溶液等体积混合:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入少量稀H2SO4,在管口观察到红棕色气体 | 溶液中NO3-被Fe2+还原成NO2 |
| B | 用铂丝蘸取溶液进行焰色反应,观察到火焰呈黄色 | 该溶液一定是钠盐溶液 |
| C | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 | 有NaHCO3晶体析出 |
| D | 常温下,将Al箔插入浓硫酸中,无明显现象 | 铝和浓硫酸常温不反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com