
| A. | 向10ml0.1mol/L的Ca(ClO)2的溶液中鼓入标态下的SO2气体44.8ml:Ca2++2ClO-+2H2O+2SO2=CaSO4↓+2Cl-+4H++SO42- | |
| B. | 向98.3%的浓硫酸中加入铜片并加热:Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+2H2O+Cu2+ | |
| C. | 向NH4HCO3溶液中加足量浓NaOH溶液并加热:HCO3-+OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO32- | |
| D. | 用氯化铵和消石灰两种固体混合加热制氨气:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
分析 A.n(SO2)=$\frac{0.0448L}{22.4L/mol}$=0.002mol,Ca(ClO)2的物质的量为0.001mol,遵循电子、电荷守恒;
B.浓硫酸在离子反应中保留化学式;
C.漏写铵根离子与碱的反应;
D.固体之间反应,不是离子反应.
解答 解:A.A.n(SO2)=$\frac{0.0448L}{22.4L/mol}$=0.002mol,Ca(ClO)2的物质的量为0.001mol,发生Ca2++2ClO-+2H2O+2SO2=CaSO4↓+2Cl-+4H++SO42-,遵循电子、电荷守恒,故A正确;
B.向98.3%的浓硫酸中加入铜片并加热:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$SO42-+SO2↑+2H2O+Cu2+,故B错误;
C.向NH4HCO3溶液中加足量浓NaOH溶液并加热的离子反应为NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3.H2O+H2O+CO32-,故C错误;
D.用氯化铵和消石灰两种固体混合加热制氨气,不是离子反应,故D错误;
故选A.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol${\;}_{\;}^{16}$OD-离子含有的电子、中子数均为1.0NA | |
| B. | 标准状况下,4.48L己烷含有的分子数为0.2NA | |
| C. | 总质量为5.6g的CaO和CaC2混合物中,所含离子总数小于0.2NA | |
| D. | 常温常压下,0.1molNH3与0.1molHCl充分反应后所得产物含0.1NA个分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水晶和干冰的熔化 | B. | 食盐和醋酸钠的熔化 | ||
| C. | 乙醇和HCl溶于水 | D. | HCl和NaCl溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
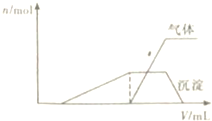 1L某混合溶液,可能含有的离子如表:
1L某混合溶液,可能含有的离子如表:| 可能大量含有的阳离子 | H+、NH+、Al3+、K+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、ClO-、AlO2- |
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )偶联可由下列两个途径制备有机化合物Ⅵ.
)偶联可由下列两个途径制备有机化合物Ⅵ.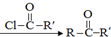
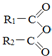 +H2O→R1-COOH+R2-COOH
+H2O→R1-COOH+R2-COOH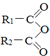

 .
. 、
、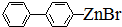 .
.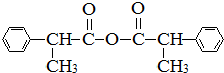 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
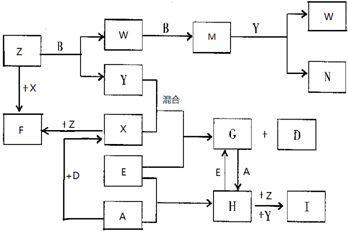
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
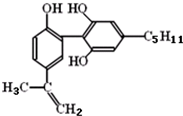
| A. | 该分子中所有碳原子一定共存于同一平面内 | |
| B. | 1mol该物质与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为4mol、7mol | |
| C. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| D. | 滴入酸性KMnO4溶液,观察到紫色褪去,可证明分子中存在碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同状况下,同体积的乙醇气体和乙烯气体究全燃烧,耗氧量不相同 | |
| B. | 在相同状况下,同体积的乙醇气体和乙烯气体完全燃烧,放出的热量相同 | |
| C. | 用乙醇作燃料不会导致“温窒效应” | |
| D. | 用乙醇作燃料不会导致酸雨 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com