
| A. | 高于409 K | B. | 低于136 K | ||
| C. | 高于136 K而低于409 K | D. | 低于409 K |
科目:高中化学 来源: 题型:解答题

 (R1~R4表示氢或烃基)
(R1~R4表示氢或烃基) .
. .
. (其中任一种).
(其中任一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将反应2Fe3++Fe═3Fe2+设计为原电池,则可用Zn为负极,Fe为正极,FeCl3为电解质 | |
| B. | 铜片和铝片用导线连接后插入浓硝酸中,铜作负极 | |
| C. | 镀锌铁和镀锡铁的镀层破损后,前者较易被腐蚀 | |
| D. | 铝片和镁片用导线连接后插入NaOH溶液中,Mg较活泼作负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
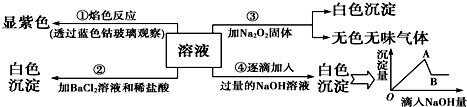
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,1L 0.1mol/L的CH3COOH溶液中的H+数为0.1NA | |
| B. | 常温常压下,30g葡萄糖含有的氧原子数为NA | |
| C. | 0.1mol/L的AlCl3溶液中含有的氯离子数为0.3NA | |
| D. | 16 g甲烷分子中含有共价键的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业制取金属钾:Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 | |
| B. | 配制氯化铁溶液时,将氯化铁加入盐酸中,然后加水稀释 | |
| C. | 向氯水中加CaCO3后,溶液漂白性增强 | |
| D. | 二氧化氮与四氧化二氮的平衡体系,加压缩小体积后颜色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na | B. | Mg | C. | Al | D. | Fe |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com