
����Ŀ�����Ṥҵ�з�����Ϊ����������ɷ�ΪSiO2��Fe2O3��Al2O3��MgO��ij̽����ѧϰС���ͬѧ������·����������������н���Ԫ�ص���ȡʵ�飮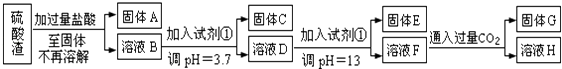
��֪��ҺpH=3.7ʱ��Fe3+�Ѿ�������ȫ��һˮ�ϰ����볣��Kb=1.8��10��5 �� �䱥����Һ��c��OH����ԼΪ1��10��3molL��1 �� ��ش�
��1��д��A������������Һ��Ӧ�����ӷ���ʽ�� ��
��2����������������ʹ���Լ��٣��Ʋ��Լ���Ӧ���� ����������ĸ��ţ�
A.����������Һ
B.������
C.��ˮ
D.ˮ
��3����ҺD������E��������Ҫ������ҺpH=13�����pH��С�����ܵ��µĺ����������дһ�㣩
��4��H�����ʵĻ�ѧʽ����
��5��������ҺF��c��Mg2+��=��25��ʱ��������þ��Ksp=5.6��10��12��
���𰸡�
��1��SiO2+2NaOH=Na2SiO3+H2O
��2��A
��3��þ���ӳ�������ȫ�����������ܽⲻ��ȫ��
��4��NaHCO3
��5��5.6��10��10mol/L
���������⣺�������ijɷ�ΪSiO2��Fe2O3��Al2O3��MgO�������������мӹ�������ʱ����������������Ӧ�����Թ���A�Ƕ������裬��������������������þ�����ᷴӦ��������ҺB���������Ȼ�þ���Ȼ������Ȼ������������ҺB�м��Լ��ٲ�������Һ��pHֵΪ3.7�����������ҺpH=3.7ʱFe3+�Ѿ�������ȫ֪���Լ������ܺ��Ȼ�����Ӧ���ɳ����������Һ������ӷ�Ӧû�г������ɣ������Լ���ֻ����ǿ����Һ������C����������������ҺD�м����Լ��ٲ�������Һ��PHֵΪ13����Һ��ǿ������Һ����Ԫ������Һ����ƫ��������Ӵ��ڣ�þ���Ӻ���������������������þ���������Թ���E��������þ����ҺF�����ʺ���ƫ�����ƺ��Ȼ��ƣ���F��Һ��ͨ�����������̼���壬ƫ�����ƺͶ�����̼��Ӧ����������������������G������������HΪ̼�����ƣ�
��1��ͨ�����Ϸ���֪��A�Ƕ������裬��������������������ܺ�ǿ�Ӧ�����κ�ˮ��
���Է�Ӧ����ʽΪ��SiO2+2NaOH=Na2SiO3+H2O��
�ʴ�Ϊ��SiO2+2NaOH=Na2SiO3+H2O��
��2������ҺB�м��Լ��ٲ�������Һ��PHֵΪ3.7���������֪����ҺpH=3.7ʱFe3+�Ѿ�������ȫ֪���Լ������ܺ��Ȼ�����Ӧ���ɳ����������Һ������ӷ�Ӧû�г������ɣ������Լ���ֻ����ǿ����Һ��������������Aѡ�
��ѡA��
��3����ǿ���������£���Ԫ����ƫ��������Ӵ��ڣ�þԪ����������þ���ڣ�����Һ��PH=13ʱ����Һ��ǿ���ԣ����pH��С�����ܵ��µĺ����þ���ӳ�������ȫ�����������ܽⲻ��ȫ�ȣ�
�ʴ�Ϊ��þ���ӳ�������ȫ�����������ܽⲻ��ȫ�ȣ�
��4��H������Ϊ̼�����ƣ��ʴ�Ϊ��NaHCO3��
��5��c��Mg2+��= ![]() =
= ![]() =5.6��10��10 mol/L
=5.6��10��10 mol/L
�ʴ�Ϊ��5.6��10��10 mol/L��
�������ijɷ�ΪSiO2��Fe2O3��Al2O3��MgO�������������мӹ�������ʱ����������������Ӧ�����Թ���A�Ƕ������裬��������������������þ�����ᷴӦ��������ҺB���������Ȼ�þ���Ȼ������Ȼ������������ҺB�м��Լ��ٲ�������Һ��pHֵΪ3.7�����������ҺpH=3.7ʱFe3+�Ѿ�������ȫ֪���Լ������ܺ��Ȼ�����Ӧ���ɳ����������Һ������ӷ�Ӧû�г������ɣ������Լ���ֻ����ǿ����Һ������C����������������ҺD�м����Լ��ٲ�������Һ��PHֵΪ13����Һ��ǿ������Һ����Ԫ������Һ����ƫ��������Ӵ��ڣ�þ���Ӻ���������������������þ���������Թ���E��������þ����ҺF�����ʺ���ƫ�����ƺ��Ȼ��ƣ���F��Һ��ͨ�����������̼���壬ƫ�����ƺͶ�����̼��Ӧ����������������������G������������HΪ̼�����ƣ���1�����ݶ���������������Ƶ�����д����Ӧ�Ļ�ѧ��Ӧ����ʽ����2����ʹ�����Ӳ����������������Ӳ���������������ֻ����ǿ���3����ǿ���������£���Ԫ����ƫ��������Ӵ��ڣ�þԪ����������þ���ڣ���4��H������Ϊ̼�����ƣ���5������c��Mg2+��= ![]() ���㣮
���㣮


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���йس�����pH��Ϊ3�Ĵ���������˵����ȷ����(����)
A. ������Һ��,��ˮ�������������Ũ�Ⱦ�Ϊ1��10-11 mol��L-1
B. �ֱ��ˮϡ��100����,������Һ��pH����ͬ
C. �����е�c(CH3COO-)�������е�c(SO42-)���
D. �ֱ��������пƬ,������Һ����H2�������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ϲ��ϵ�ʹ��ʹ������������˺ܴ����ߣ�����Ҫԭ����( )
A.���ϲ��ϵ�ʹ�ÿ���ʹ�������ܳ����µı仯
B.���ϲ��ϵ�ʹ�ÿ���ʹ��������������
C.���ϲ��ϵ�ʹ�ÿ���ʹ���������¶ȵľ��ұ仯
D.���ϲ��ϵ�ʹ�ÿ���ʹ�������ܳ���ǿ�ȵı仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ұ��ṩ���ݼ�������ʽṹ֪ʶ����Ӧ��SiCl4(g)+2H2(g)��Si(s)+4HCl(g)������1mol
��������ЧӦ��
��ѧ�� | Si-Cl | H-H | Si-Si | H-Cl |
����(kJ/mol) | 360 | 436 | 176 | 431 |
A.����236kJB.�ų�236kJC.�ų�116kJD.����116kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ͻ�����ɳɷ���Ƚϣ��Ͻ��
A. ���ܲ� B. �ܶȴ�
C. �۵�ߣ�Ӳ��С D. �۵�ͣ�Ӳ�ȴ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����m g��������������ͭ��������������ƷͶ�����ʵ���Ũ��Ϊ1 mol/L��2 L������ǡ����ȫ��Ӧ������������ĸ���Ʒ��ͨ�����������������ȣ���ַ�Ӧ�����ý����������� (����)
A. (m��16)g B. (m��16)g
C. (m��32)g D. 16g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(H3PO2)��һ�־�ϸ������Ʒ�����н�ǿ��ԭ�ԣ��ش���������:
��1��H3PO2��һԪ��ǿ�ᣬ��H3PO2(aq)������Ũ�ȵ�˳��Ϊ:__________��
��2��H3PO2��NaH2PO2���ɽ���Һ�е�Ag+��ԭΪ�����Ӷ������ڻ�ѧ����
��H3PO2�У���Ԫ�صĻ��ϼ�Ϊ_____
������H3PO2���л�ѧ������Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ4:1,����������Ϊ___(�ѧʽ);
��NaHPO2Ϊ____(����������������ʽ����),����Һ��_____����������������������������������).
��3��H3PO2�Ĺ�ҵ�Ʒ��ǽ�����(P4)��Ba(OH)2��Һ��Ӧ����PH3�����Ba(H3PO2),��������H2SO4��Ӧ��д��������Ba(OH)2��Һ��Ӧ�Ļ�ѧ����ʽ:____________��
��4��H3PO2Ҳ���õ��������Ʊ��������ҵ�������������ԭ����ͼ��ʾ(��Ĥ����Ĥ�ֱ�ֻ���������ӣ�������ͨ��):
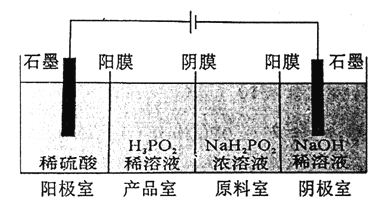
��д�������ĵ缫��Ӧʽ��___________�ڷ�����Ʒ�ҿɵõ�H3PO2��ԭ��:__________
��5������(H3PO4) ��ˮ��Һ�и��ִ�����ʽ���ʵ�����������pH�ı仯������ͼ:
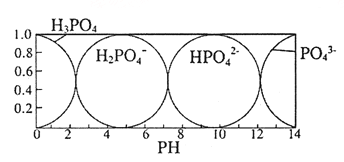
����Na3PO4��Һ�е���ϡ�����pH��10���͵�5�Ĺ����з�������Ҫ��Ӧ�����ӷ���ʽΪ______��
�ڴ�ͼ���ƶ�NaH2PO4��Һ�и�����Ũ�ȴ�С��ϵ��ȷ����_______��(��ѡ����ĸ)
A��c(Na+) >c(H2PO4-) >c(H+) >c(HPO42-) >c(H3PO4)
B��c(Na+) >c(H2PO4-) >c(OH-)>c(H3PO4) >c(HPO42-)
C��c(H+)+ c(Na+)= c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-)+ c(H3PO4)
D��c(Na+)= c(H2PO4-)+c(HPO42-)+c(PO43-)+ c(H3PO4)
�ۼ�����25��ʱ���0.1 mol��L-1Na3PO4��Һ��pH=12�����Ƽ����Na3PO4��һ��ˮ���ˮ�ⳣ��(��Kh��ʾ) Kh=______mol��L-1(����Na3PO4�ڶ���������ˮ�⣬���������λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʹ1mol��ϩ������������ȫ�ӳɷ�Ӧ��Ȼ��ʹ�üӳɷ�Ӧ�IJ����������ڹ��յ������·���ȡ����Ӧȫ������C2H2Cl4 �� ���������������ĵ��������ܵ����ʵ����ǣ� ��
A.3mol
B.4mol
C.5mol
D.6mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A-I֮���ת����ϵ��ͼ��ʾ

��֪A���������ʣ�
I.������ֻ�и�ȡ������
II.�˴Ź���������������壻
III.��ʹBr2��CC14��Һ��ɫ������NaHCO3��Һ��Ӧ�ų����塣
��ش�
��1��A�е����������ŵ�����Ϊ__________________���۵ķ�Ӧ����Ϊ__________________________��
��2��H�ķ���ʽΪ____________________________��
��3��GΪ�Ӿ۲�����Ӧ�Ļ�ѧ����ʽΪ________________________________��
��4��д��C�������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ___________________________��
��5����������������Fͬ���칹����______��(�����������칹)��д�������ϵ�һ�ȴ���ֻ��һ�ֵĽṹ��ʽ_____________________��
a.���ܷ���ˮ�ⷴӦ
b.������������ȡ����
c.1molF��ͬ���칹������������Һ��Ӧ����4molAg
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com