
����Ŀ����Li��ʯī�ĸ��ϲ����Լ�����Fe2O3�������缫������ӵ�أ���ѭ����ŵ�����п�ʵ�ֶԴ��ԵĿ������(��ͼ)�������й�˵��һ���������
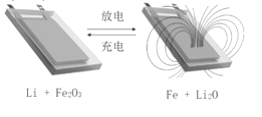
A. �õ�صĵ������Һ������������Һ
B. �ŵ�ʱ���ܷ�Ӧʽ��6Li+Fe2O3=3Li2O+2Fe
C. ���ʱ�������ĵ缫��Ӧ��2Fe+3Li2O-6e-= Fe2O3+6Li+
D. ��ŵ�����У���ؿ��ڱ�����������������֮��ѭ������
���𰸡�A
��������
A.��Ϊ�õ���к���Li��Fe2O3�������������ᷴӦ����A����
B.�ŵ�ʱ��Li��Ϊ������ʧ���ӱ�����������Fe2O3�õ��ӱ���ԭ���ʷŵ�ʱ���ܷ�Ӧʽ��6Li+Fe2O3=3Li2O+2Fe����B��ȷ��
C.���ʱ�������������෴�������ĵ缫��Ӧ��2Fe+3Li2O-6e-= Fe2O3+6Li+����C��ȷ��
D.������Ŀ��ʾ��ͼ���������Ǵ�������Ĺ��̣����Կ������û�б�������������Ϊ�����̵�����ת����������Fe��Li2Oת��ΪLi��Fe2O3����˳��ʱ��ز��ܱ������������ŵ���̵�����ת������Li��Fe2O3ת��ΪFe��Li2O���������ɣ���˷ŵ�ʱ��ر�������������D��ȷ��
��ѡA��


 �㽭��У��ʦ���ϵ�д�
�㽭��У��ʦ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����������֮����һ�����������ת���Ĺ��̡���������ɫֲ��ͨ��������õ�ͼʾ����˵������ȷ����
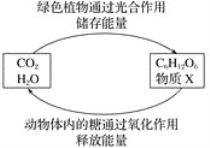
A.����X������
B.��ɫֲ��Ĺ���������ڻ�ѧ�仯
C.C6H12O6���ڷǵ����
D.C6H12O6��X��Ӧ���ɶ�����̼��ˮ�����û���Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��298Kʱ��N2��H2��Ӧ�����������仯������ͼ��������������ȷ����
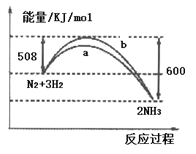
A. ���¶ȡ����һ���������£�ͨ��1mol N2��3mol H2 ��Ӧ��ų�������Ϊ92kJ
B. a�����Ǽ������ʱ�������仯����
C. ���������Ҳ�������N2��ת����
D. �÷�Ӧ���Ȼ�ѧ����ʽΪ��N2��g��+3H2��g��![]() 2NH3��g�� ��H=��92 kJ/mol
2NH3��g�� ��H=��92 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҳ���Ũ�����������ط�����Ӧ�����Ʊ���������ѧ����ʽΪ��2KMnO4+16HCl(Ũ)=2MnCl2+2KCl+5Cl2��+8H2O��
��1���������ŷ���ʾ�÷�Ӧ�����еĵ���ת�������________________���÷�Ӧ��HCl��������δ�����������ʵ���֮��Ϊ________��
��2������װ��Ϊʵ�����Ʊ�������װ�á�

װ��C��������______________________��װ��E��������_______________________________��װ��F�е��Լ���_________________��
��3��д��F�з��������ӷ�Ӧ����ʽ________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)������Na2S��Һʱ��Ϊ������ˮ�⣬���Լ���������________(�ѧʽ)����ˮ������ӷ���ʽΪ____________��
(2)0.1 mol/L��NaHCO3��Һ��pHΪ8��ͬŨ�ȵ�AlCl3��Һ��pHΪ4����������Һ�������ϣ����ܷ�����������____________________________����Ҫԭ����(�����ӷ���ʽ��ʾ) ______________________________��
(3)����������ˮ�����侻ˮԭ�������ӷ���ʽ�ɱ�ʾΪ____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��X(g)+2Y(g)![]() 3Z(g) ��H=-akJ��mol-1(a>0)������˵������ȷ����
3Z(g) ��H=-akJ��mol-1(a>0)������˵������ȷ����
A. 0.1molX��0.2molY��ַ�Ӧ����Z�����ʵ���һ��С��0.3mol
B. �ﵽ��ѧƽ��״̬ʱ��X��Y��Z��Ũ�Ȳ��ٷ����仯
C. �ﵽ��ѧƽ��״̬ʱ����Ӧ�ų����������ɴ�a Kj
D. ���߷�Ӧ�¶ȣ��淴Ӧ������������Ӧ���ʼ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
��0.1mol��L-1 ��ˮ����c(OH-)��c(NH 4��)
��10mL 0.02mol��L-1 HCl ��Һ�� 10mL0.02mol��L-1Ba(OH)2 ��Һ��ֻ��������Ϻ���Һ�����Ϊ 20mL������Һ�� pH��12
���� 0.1mol��L-1 CH COONa ��Һ����c(OH-)��c(CH COOH)��c(H��)
��0.1mol��L-1 ij��Ԫ������ʽ�� NaHA ��Һ����c(Na��)��2c(A2-)��c(HA-)��c(H A)
A. �٢� B. �ڢ� C. �ۢ� D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�ַǽ��������������������ϡ��������ҵ������
��l��Se��Ԫ�����ڱ��е�34��Ԫ�أ����̬ԭ�ӵĺ�������Ų�ʽΪ__��
��2�����ݼ۲���ӶԻ������ۣ�������֪SeO3�ķ��ӿռ乹��Ϊ__������Seԭ�Ӳ��õĹ���ӻ���ʽΪ__��
��3��CSe2��CO2�ṹ���ƣ�CSe2�����ڦҼ���м�����֮��Ϊ__��CSe2�״�����H2Se��CCl4��Ӧ����ȡ�ģ�CSe2�����ڵ�Se��C��Se����__������ڡ��������ڡ���С�ڡ���H2Se�����ڵ�H��Se��H���ǡ�
��4������慨������ڷ�өʯ�ͽṹ�������ṹ��ͼ��ʾ��ÿ�������а���__��Rb2Se��Ԫ������Se2����Χ���������������ȵ�Rb+��������ĿΪ__��
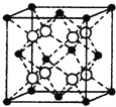
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǻ�ѧʵ���Ҽ����������е���Ҫ���ʣ�Ӧ�ù㷺��N2(g)��3H2(g)![]() 2NH3(g) ��H=-92.2kJ/mol
2NH3(g) ��H=-92.2kJ/mol
��1���ں��º����ܱ������н��кϳɰ���Ӧ����ʼͶ��ʱ������Ũ�����±���
N2 | H2 | NH3 | |
Ͷ�Ϣ� | 1.0 mol/L | 3.0 mol /L | 0 |
Ͷ�Ϣ� | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
�ٰ�Ͷ�Ϣ���з�Ӧ����ôﵽ��ѧƽ��״̬ʱH2��ת����Ϊ40%������¶��ºϳɰ���Ӧ��ƽ�ⳣ������ʽΪ_____________��
�ڰ�Ͷ�Ϣ���з�Ӧ����ʼʱ��Ӧ���еķ���Ϊ________�������������
���������¶ȣ���ϳɰ���Ӧ�Ļ�ѧƽ�ⳣ��________����������С�����䡱����
��2��L��L1��L2����X�ɷֱ����ѹǿ���¶ȡ���ͼ��ʾLһ��ʱ���ϳɰ���Ӧ��H2(g)��ƽ��ת������X�ı仯��ϵ��

�� X��������������______��
�� �ж�L1��L2�Ĵ�С��ϵ�����������ɣ�______��
��3���绯ѧ���������������ڼ�����NH3�ĺ������乤��ԭ��ʾ��ͼ���£�

�� �缫b�Ϸ�������______��Ӧ�����������ԭ����
�� д���缫a�ĵ缫��Ӧʽ��_________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com