
【题目】为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
探究一:
(1)将已去除表面氧化物的铁钉(碳素钢-含杂质碳)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是____________________________________________________。
(2)称取碳素钢6.0g放入15.0ml浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用____________(选填序号)。
A.KSCN溶液和氯水 B.铁粉和KSCN溶液 C.浓氨水 D.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4反应,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数的方法为_________________________________。
探究二:根据上述实验中SO2体积分数(80%)的分析,丙同学认为气体Y中还可能含有氢气和二氧化碳两种气体,为此设计了下列探究实验装置(假设有关气体完全反应)
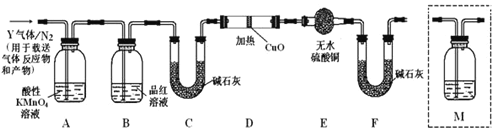
(3)装置B中试剂的作用是_______________________________________;
(4)分析Y气体中的CO2气体是如何生成的______(用化学方程式表示)。
(5)已知洗气瓶M中盛装澄清石灰水,为确认CO2的存在,需在装置中添加洗气瓶M于____________(填序号)。
A.A之前 B.A-B间 C.B-C间 D.C-D间
(6)如果气体Y中含有H2,预计实验现象应是_______________________。
【答案】 铁在冷的浓硫酸中钝化,表面生成致密氧化膜 D 根据沉淀的量计算出二氧化硫的量再计算出体积分数 确认二氧化硫已经除尽 C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O C D中氧化铜变红,E中无水硫酸铜变蓝
CO2↑+2SO2↑+2H2O C D中氧化铜变红,E中无水硫酸铜变蓝
【解析】(1)铁在冷的浓硫酸中钝化,表面形成一层致密的氧化物薄膜,阻止了铁与铜离子间的置换反应发生; 正确答案:铁在冷的浓硫酸中钝化,表面生成致密氧化膜。
(2)①检验Fe3+中是否含有Fe2+,加入KSCN溶液,Fe3+与SCN-反应使溶液变红,无法检验Fe2+是否存在,A错误;加入铁粉,把Fe3+还原为Fe2+,而Fe2+与KSCN溶液没有现象出现,不能检验Fe2+,B错误;加入浓氨水,生成氢氧化铁红褐色沉淀干扰了亚铁离子产生的沉淀,无法确定是否存在Fe2+,C错误;加入酸性KMnO4溶液,把Fe2+氧化为Fe3+,酸性KMnO4溶液紫色褪去,而酸性KMnO4溶液不能氧化Fe3+,方法可取,D正确;正确选项D。
②已知SO2+Br2+2H2O=2HBr+H2SO4反应,硫酸与BaCl2溶液反应生成硫酸钡沉淀4.66g,即0.02mol;根据硫原子守恒规律n(BaSO2)=n(H2SO4)= n(SO2)=0.02 mol,混合气体共有560mL(标准状况)即0.025 mol,气体Y中SO2的体积分数0.02/0.025×100%=80%;综上可以根据沉淀的量计算出二氧化硫的量再计算出体积分数;正确答案:根据沉淀的量计算出二氧化硫的量再计算出体积分数。
(3)酸性高锰酸钾溶液氧化SO2气体,目的要除去SO2气体,而装置B中的品红溶液是检验SO2气体是否除尽;正确答案:确认二氧化硫已经除尽。
(4)碳素钢中含有杂质碳,它与浓硫酸加热反应生成二氧化碳、二氧化硫和水;化学方程式:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;正确答案:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;正确答案:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
(5)SO2气体除尽后,应在B-C间加入盛装澄清石灰水的洗气瓶M,如果石灰水变浑浊,证明有CO2的存在;然后把气体通过碱石灰的干燥管进行干燥,进行氢气检验实验;正确答案:C。
(6)SO2气体除尽后,应在B-C间加入盛装澄清石灰水的洗气瓶M,如果石灰水变浑浊,证明有CO2的存在;然后把气体通过碱石灰的干燥管进行干燥,气体进入装置D中,利用氢气的还原性还原氧化铜,黑色固体变成红色,无水硫酸铜变为蓝色,说明确实有氢气存在;正确答案:D中氧化铜变红,E中无水硫酸铜变蓝。


科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法不正确的是( )
A.铝制容器可长期存放碱性食物
B.水玻璃浸泡过的木材能防腐
C.过氧化钠用作呼吸面具中的供氧剂
D.氯气用于农药的生产和药物合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+mY(g)3Z(g),平衡时,X,Y,Z的体积分数分别为30%、60%、10%,在此平衡体系中加入1molZ(g),再将达到平衡后,X,Y,Z的体积分数不变.下列叙述不正确的是( )
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1:1
D.第二次平衡时,Z的浓度为0.4molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)请填空: 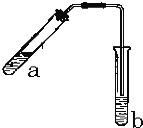
(1)试管a中需要加入 浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序入操作是
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是
(3)实验中加热试管a的目的是:①②
(4)试管b中加有饱和Na2CO3溶液,其作用是
(5)反应结束后,振荡试管b静置,观察到的现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述中,不正确的是
A. 胶体是一种介稳体系 B. 胶体中分散质粒子的直径小于1 nm
C. 利用丁达尔效应可以区分溶液和胶体 D. 用滤纸能分离胶体和悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图.下列对该化合物叙述正确的是( ) 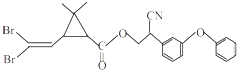
A.属于芳香烃
B.属于卤代烃
C.在酸性条件下不水解
D.在一定条件下可以发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如下图所示.A元素的某种同位素原子没有中子,D元素的原子序数是C的2倍,E是短周期主族元素中半径最大的元素.下列说法不正确的是( )
A.简单离子的半径大小关系:B>C>E
B.D,E两种元素形成的化合物,可能含有离子键和共价键
C.A,B,C三种元素形成的化合物,晶体类型一定相同
D.B,D分别和C形成的化合物,都有可能使溴水或品红溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有200mL MgCl2、AlCl3的混合液,其中c(Mg2+)=0.2mol·L-1 ,c(Cl-)=1.3 mol·![]() 。要使Mg2+转化成Mg(OH)2,并使Mg2+和Al3+分离开来,至少需要4 mol·L-1的NaOH溶液
。要使Mg2+转化成Mg(OH)2,并使Mg2+和Al3+分离开来,至少需要4 mol·L-1的NaOH溶液
A. 140mL B. 120mL C. 100mL D. 80mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com