
A��c(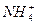 )=c(Na+)=c(OH-)��c(NH3��H2O) )=c(Na+)=c(OH-)��c(NH3��H2O) |
B��c(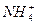 )=c(Na+)��c(NH3��H2O)��c(OH-) )=c(Na+)��c(NH3��H2O)��c(OH-) |
C��c(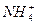 )��c(Na+)��c(OH-)��c(NH3��H2O) )��c(Na+)��c(OH-)��c(NH3��H2O) |
D��c(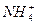 )��c(Na+)��c(NH3��H2O)��c(OH-) )��c(Na+)��c(NH3��H2O)��c(OH-) |
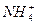 ��ʣ�࣬��������NH3��H2O�����
��ʣ�࣬��������NH3��H2O�����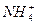 ˮ�⣬��c(NH3��H2O)=c(
ˮ�⣬��c(NH3��H2O)=c(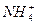 )=c(Na+)="0.5" mol��L-1����ʱ���ǵ����ˮ�⣺NH3��H2O
)=c(Na+)="0.5" mol��L-1����ʱ���ǵ����ˮ�⣺NH3��H2O
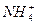 +OH-��,
+OH-��, 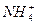 +H2O
+H2O NH3��H2O+H+�ڡ��ٷ���ʹ��Һc(
NH3��H2O+H+�ڡ��ٷ���ʹ��Һc(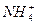 )���ڷ�Ӧʹ��Һc(
)���ڷ�Ӧʹ��Һc(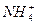 )��С����Һc(
)��С����Һc(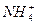 )�������Ǽ�С��ȡ����������Ӧ��һ��Ϊ��Ҫ�����ݾ�������֪���ε�ˮ���������ʵĵ��룬�Ե���Ϊ�������c(
)�������Ǽ�С��ȡ����������Ӧ��һ��Ϊ��Ҫ�����ݾ�������֪���ε�ˮ���������ʵĵ��룬�Ե���Ϊ�������c(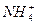 )������c(Na+)��ͬ��c(NH3��H2O)Ӧ���٣�С��c(Na+)����Һ��c(OH-)����NH3��H2O���룬���������c(OH-)Ũ�Ⱥ�С������Ũ��˳��Ϊc(
)������c(Na+)��ͬ��c(NH3��H2O)Ӧ���٣�С��c(Na+)����Һ��c(OH-)����NH3��H2O���룬���������c(OH-)Ũ�Ⱥ�С������Ũ��˳��Ϊc(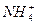 )��c(Na+)��c(NH3��H2O)��c(OH-)��
)��c(Na+)��c(NH3��H2O)��c(OH-)��

 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ʵ���� | HA��Ũ��(mol��L-1) | NaOH��Ũ��(mol��L-1) | �����Һ��pH |
| �� | 0.2 | 0.2 | pH��a |
| �� | c | 0.2 | pH��7 |
| �� | 0.2 | 0.1 | pH��7 |
| �� | 0.1 | 0.1 | pH��9 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.2mol��L-1K2CO3 |
| B��0.1mol��L-1Ba(OH)2 |
| C��0.2mol��L-1NaCl |
| D��0.2mol��L-1(NH4)2SO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 Mg2++2OH- ��
Mg2++2OH- �� +H2O
+H2O NH3��H2O+H+ ��
NH3��H2O+H+ �� Mg2++2OH- ��
Mg2++2OH- �� +OH-====NH3��H2O ��
+OH-====NH3��H2O ��| A��NH4NO3 | B��CH3COONH4 |
| C��(NH4)2SO4 | D����ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
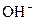 ��
��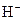 ��
��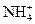 ��
��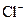 �������ӣ���Ũ�ȴ�С�����¹�ϵ�����п��ܵ��ǣ�����
�������ӣ���Ũ�ȴ�С�����¹�ϵ�����п��ܵ��ǣ�����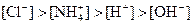
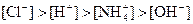
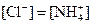 ��
��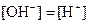
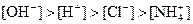
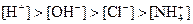
| A���٢� | B���ۢ� |
| C���٢ڢ� | D���ܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������ʵ���Ũ��NaCl��CH3COONa��Һ�������ϣ� c(Cl-)>c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B��25��ʱ����10mL���ᣨpHa����100mLBa��OH��2��Һ��pHn����Ϻ�ǡ���кͣ���pHa+pHn=13 |
| C�������ʵ���Ũ�ȵ��������������Һ�������ϣ�c��SO42-��+c��OH-��=c��H+��+c��CH3COOH�� |
D����ˮ�м�ˮϡ�ͣ� ��С ��С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| �������� | NO-3 | SO2-4 | H+ | Na+ | Mn+ |
| Ũ�ȣ�mol��L-1�� | 3 | 1 | 2 | 1 | a |
| A��Mg2+��1 | B��Ba2+��0.5 | C��Al3+��1.5 | D��Fe2+��2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com