
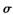 键和
键和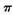 键个数之比为____________。
键个数之比为____________。
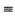 Y放出942KJ热量。试写出由Y4气态分子变成Y2气态分子的热化学方程式___
Y放出942KJ热量。试写出由Y4气态分子变成Y2气态分子的热化学方程式___ _____________________
_____________________ 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
| 原子序数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| E/eV | 13.4 | 24.6 | 5.4 | 9.3 | 8.3 | 11.3 | 14.5 | 13.6 | 17.4 | 21.6 |
| 原子序数 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | |
| E/eV | 5.1 | 7.6 | 6.0 | 8.1 | 11.0 | 10.4 | 13.0 | 15.8 | 4.3 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 数与电子层数相同。最高价氧化物与强酸反应的离子方程式为________________________________(2分),最高价氧化物对应水化物与氢氧化钾反应的化学方程式为 _________________________________________(2分)。
数与电子层数相同。最高价氧化物与强酸反应的离子方程式为________________________________(2分),最高价氧化物对应水化物与氢氧化钾反应的化学方程式为 _________________________________________(2分)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.K、Na、Li | B.Al、Mg、Na | C.N、O、C | D.Cl、S、P |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe:1s22s22p63s23p63d54s3 | B.F ˉ:1s22s22p6 |
| C.K:1s22s22p63s23p64s1 | D.Kr:1s22s22p63s23p63d104s24p6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X2+具有还原性 | B.X的最高价氧化物具有强氧化性 |
| C.该元素是第ⅥA族元素 | D.X的+2价化合物比+4价化合物稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 件下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质能剧烈反应生成A的单质。所得溶液中含有与氖原子的电子层结构相同的阳离子。
件下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质能剧烈反应生成A的单质。所得溶液中含有与氖原子的电子层结构相同的阳离子。 ___________。
___________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 件下)。A、C、E都为氢化物,三者中C的相对分子质量最小;A、C具有相同的电子数;D、E、F都为氧化物,且D、F皆为有毒气体。则:
件下)。A、C、E都为氢化物,三者中C的相对分子质量最小;A、C具有相同的电子数;D、E、F都为氧化物,且D、F皆为有毒气体。则:
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
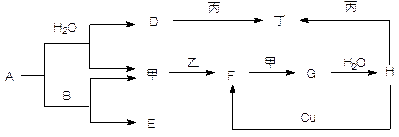
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com