
(每空1分 共10分) 氮是地球上极为丰富的元素。
(1) Li3N晶体中氮以N3-的存在,基态N3-的电子排布图为 。
(2)N≡N的键能为942 kJ·mol-1,N–N单键的键能为247 kJ·mol-1,计算说明N2中的 键比 键稳定(填“σ”或“π”)。
(3)(CH3)3NH+和AlCl4-可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂 (填“大”或“小”),可用作 。(填代号)
a.助燃剂 b.“绿色”溶剂 c.复合材料 d.绝热材料
科目:高中化学 来源:2012-2013学年四川省南山中学高二10月月考化学试卷(带解析) 题型:填空题
(每空1分 共10分) A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为: ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。
回答下列问题:
(1)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(2) D的氢化物比C的氢化物的沸点_____(填"高"或"低"),原因____________。
(3)E元素在周期表的位置是 。
(4)画出D的核外电子排布图_________________________________________,这样排布遵循了 原理、____________原理和____________规则。
(5)用电子式表示B的硫化物的形成过程:______________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省南山中学高二10月月考化学试卷(带解析) 题型:填空题
(每空1分 共10分)氮是地球上极为丰富的元素。
(1) Li3N晶体中氮以N3-的存在,基态N3-的电子排布图为 。
(2)N≡N的键能为942 kJ·mol-1,N–N单键的键能为247 kJ·mol-1,计算说明N2中的 键比 键稳定(填“σ”或“π”)。
(3)(CH3)3NH+和AlCl4-可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂 (填“大”或“小”),可用作 。(填代号)
a.助燃剂 b.“绿色”溶剂 c.复合材料 d.绝热材料
查看答案和解析>>
科目:高中化学 来源:2014届四川省高二10月月考化学试卷(解析版) 题型:填空题
(每空1分
共10分)
A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为: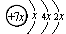 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。
回答下列问题:
(1)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(2) D的氢化物比C的氢化物的沸点_____(填"高"或"低"),原因____________。
(3)E元素在周期表的位置是 。
(4) 画出D的核外电子排布图_________________________________________,这样排布遵循了 原理、____________原理和____________规则。
(5) 用电子式表示B的硫化物的形成过程:______________________________。
查看答案和解析>>
科目:高中化学 来源:2013届陕西省高二下学期期中考试化学试题(解析版) 题型:填空题
(每空2分共10分)
I.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2 + H2 CO + H2O,
CO + H2O,
回答下列问题:
(1)在830℃条件下,反应达到平衡时CO2的转化率为50%。若把体系温度降至800℃求得平衡常数K1=0.81,可以推知该反应的正反应为__________反应(填“吸热”、“放热”)。
(2)800℃时,某时刻测得体系中各物质的量如下:n(CO2)=1.2mol,n(H2)=1.5mol,n(CO)=0.9mol,n(H2O)=0.9mol,则此时该反应 进行.(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
II.向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应X(g)+2Y(s)  2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。

(1)0~10min 容器内气体的压强逐渐 ___________。(填“变大”、“变小”或“无法确定”)
(2)推测在第7min时曲线变化的原因可能是 ___第13min时曲线变化的原因可能是 __(填序号)
①增加Z的量 ②增加X的量 ③升温 ④降温 ⑤使用催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com