
| A. | 离子半径:Na+>Mg2+>Al3+>F - | |
| B. | 热稳定性:HCl>H2S>PH3>AsH3 | |
| C. | 酸性强弱:H2CO3<H3PO4<H2SO4<HClO4 | |
| D. | 碱性:KOH>NaOH>Mg(OH)2>Al(OH)3 |
分析 A.具有相同电子排布的离子中,原子序数大的离子半径小;
B.非金属性越强,对应氢化物越稳定;
C.非金属性越强,对应最高价含氧酸的酸性越强;
D.金属性越强,对应碱的碱性越强.
解答 解:A.具有相同电子排布的离子中,原子序数大的离子半径小,则离子半径:F->Na+>Mg2+>Al3+,故A错误;
B.非金属性越强,对应氢化物越稳定,则热稳定性:HCl>H2S>PH3>AsH3,故B正确;
C.非金属性越强,对应最高价含氧酸的酸性越强,则酸性强弱:H2CO3<H3PO4<H2SO4<HClO4,故C正确;
D.金属性越强,对应碱的碱性越强,则碱性:KOH>NaOH>Mg(OH)2>Al(OH)3,故D正确;
故选A.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源:2017届河北省高三上第二次模拟化学试卷(解析版) 题型:填空题
前四周期的A、B、C、D四种元素在周期表中均与元素X紧密相邻.已知元素X最高价氧化物的化学式为X2O5,B、D同主族且B元素的原子半径是同族元素中最小的,C的最高价氧化物对应的水化物是强酸.
(1)D元素基态原子的电子排布式为____________.
(2)A、C、X三种元素原子的第一电离能由大到小的顺序为_______________(用相应的元素符号作答).
(3)B、X、D氢化物的沸点由高到低的顺序为_______________(用相应的化学式作答).
(4)E元素是A元素所在周期中电负性最大的,试推测下列微粒的立体构型:
微粒 | EO2﹣ | EO3﹣ |
立体构型名称 |
(5)元素B的一种氢化物B2H4具有重要的用途.有关B2H4的说法正确的是____________.
A.B2H4分子间可形成氢键 B.B原子是sp3杂化
C.B2H4分子中含有5个σ键和1个π键 D.B2H4晶体变为液态时破坏共价键
(6)F元素基态原子M层上有5对成对电子,F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如图所示)中F原子的配位数之比为____________,δ、γ、α三种晶胞的边长之比为____________。
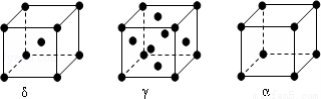
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为提高粮食产量,应大量使用化肥和农药 | |
| B. | 生活中,可以用无毒的聚乙烯薄膜包装食品 | |
| C. | 人体缺铁会引起贫血疾病 | |
| D. | 糖类、油脂、蛋白质等都是人类维持生命和健康所必需的营养物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
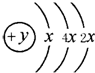 A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B、D同周期,C、D同主族,A的原子结构示意图如图,B、C可形成离子化合物B2C2或B2C据此填空:
A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B、D同周期,C、D同主族,A的原子结构示意图如图,B、C可形成离子化合物B2C2或B2C据此填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤⑦ | B. | ①②⑦ | C. | ②④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离产生的c(H+)=1×10-13mol/L的溶液中:K+、Ba2+、Cl-、NO3- | |
| B. | 使紫色石蕊试液变红的溶液中:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 在酸性高锰酸钾溶液中:Na+、NH4+、I-、ClO- | |
| D. | 在FeCl3溶液中:K+、Na+、SO42-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上第四次模拟化学试卷(解析版) 题型:选择题
下列各组中的物质均能发生加成反应的是
A.乙烯和乙醇 B.苯和氯乙烯 C.乙酸和溴乙烷 D.丙烯和丙烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com