
| A. | 向氨水中不断通入CO2,随着CO2的增加,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断减小 | |
| B. | 在铜的精炼过程中,若转移1mol电子,则阳极一定溶解32gCu | |
| C. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)△H>0,△S<0 | |
| D. | 将如图中的活塞快速推至A处固定,气体颜色先变深、再变浅,但比起始时深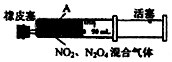 |
分析 A.氨水存在电离平衡NH3•H2O?NH4++OH-,向氨水中不断通入CO2,CO2呈酸性,使平衡向正反应方向进行,故c(OH-)增加,c(NH3•H2O)减小,则$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增加;
B.在铜的电解精炼过程中,若转移1mol电子,则阳极溶解的不仅仅是铜,还有铁锌等金属,故铜的质量小于32gCu;
C.该反应能自发进行,且△S<0,应满足△H-T•△S<0,以此进行判断;
D.左侧压缩体积变小,二氧化氮的浓度变大气体颜色先变深,后平衡正向移动颜色逐渐变浅.
解答 解:A.氨水存在电离平衡NH3•H2O?NH4++OH-,向氨水中不断通入CO2,CO2呈酸性,使平衡向正反应方向进行,故c(OH-)增加,c(NH3•H2O)减小,则$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增加,故A错误;
B.在铜的电解精炼过程中,若转移1mol电子,则阳极溶解的不仅仅是铜,还有铁锌等金属,故铜的质量小于32gCu,故B错误;
C.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)能自发进行,应满足△H-T•△S<0,该反应为熵减反应,即△S<0,说明是放热反应,△H<0,故C错误;
D.左侧压缩体积变小,二氧化氮的浓度变大气体颜色先变深,后平衡正向移动颜色逐渐变浅,平衡移动的结果是减弱而不是抵消,所以颜色比原来深,故D正确;
故选D.
点评 本题考查了平衡移动、电解原理、能够根据焓变和熵变判断反应能否自发进行,以及压强对化学平衡的影响,难度不大,可根据勒夏特里原理来分析解答即可.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年重庆市高二上第一次月考化学卷(解析版) 题型:实验题
滴定法是分析化学中常用实验方法,请根据滴定法的有关知识回答下列问题:
Ⅰ、某学生用0.1 mol·L-1 的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上1~2cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)_________AF。
(2)上述B步骤操作的目的是______________。
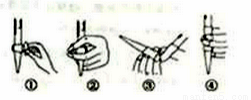
(3)在进行C步操作滴定前排气泡时,应选择下图2中的__________(填序号),若用25mL滴定管进行实验,当滴定管中的液面在“10”处,则管内液体的体积(填序号)__________(①=10mL,②=15mL,③<10mL,④>15mL)。
(4)判断以下操作,对测定结果盐酸浓度的影响(填“偏高”、“偏低”或““无影响”)
①上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响是_________。
②若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对滴定结果产生的影响是___________。
③如果滴定前装有待测溶液的酸式滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将____________。
Ⅱ、氧化还原滴定法实际生产中运用较为广泛的方法。制备纳米TiO2的方法之一是TiCl4在加热条件下水解生成TiO2·xH2O,经过过滤、水洗除去其中的Cl-,再经烘干、焙烧除去水分,最后得到粉体TiO2。
可用氧化还原滴定法测定TiO2的质量分数。在一定条件下,将粉体溶解并将溶液中的Ti2-氧化为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。【注:NH4Fe(SO4)2是一种复盐,含有两种阳离子】。请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为_______________________。
(2)配制NH4Fe(SO4)2标准溶液时,加入一定量稀H2SO4的原因是____________________,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需用到图中的______________(填序号)
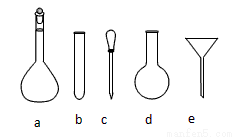
检验TiO2·xH2O中Cl-是否被除净的方法是________________________。
(3)滴定终点的现象是:当滴入最后一滴NH4Fe(SO4)2标准溶液时_______________________。
(4)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)粉体试样wg,消耗v ml c mol·L-1 NH4Fe(SO4)2标准溶液。则TiO2质量分数表达式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
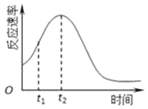 已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.
已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.| 实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 溶液体积/mL | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
| ① | 常温 | 1 | 40 | 100 | 60 | t1 |
| ② | 常温 | A | B | C | 60 | t2 |
| ③ | 常温 | 3 | 80 | D | E | t3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若管道漏气遇氨就会产生白烟 | B. | 该反应利用了Cl2的强氧化性 | ||
| C. | 生成1 mol N2有3 mol 电子转移 | D. | 该反应不属于复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用灼烧的方法可以区分蚕丝和人造纤维 | |
| B. | 食用油反复加热会产生稠环芳香烃等有害物质 | |
| C. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| D. | 用聚氯乙烯代替聚乙烯作食品包装袋,有利于节约成本 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X只能形成一种氧化物 | |
| B. | 化合物YX比WX3的熔点高 | |
| C. | 元素W的最高价氧化物对应水化物的酸性比Z的弱 | |
| D. | 原子半径的大小顺序:r(X)<r(Y)<r(Z)<r(W) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:D>C | B. | 四种元素一定属于短周期元素 | ||
| C. | 单质的还原性:B>A | D. | 原子序数:b>a>c>d |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${V}_{N{H}_{3}}$=0.6mol/L•min | B. | ${V}_{{N}_{2}}$=0.005mol/L•s | ||
| C. | ${V}_{{H}_{2}}$=0.9mol/L•min | D. | ${V}_{N{H}_{3}}$=0.02mol/L•s |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com