
【题目】数字化实验是利用传感器和信息处理终端进行数据采集与分析的实验手段。下图是利用数字化实验测定光照氯水过程中得到的图像,该图像表示的意义是
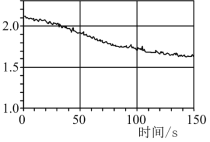
A.氯离子浓度随时间的变化
B.氧气体积分数随时间的变化
C.氯水的pH随时间的变化
D.氯水导电能力随时间的变化
 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】铁及其化合物与人类生产、生活息息相关。
(1)FeCl3可用作止血剂。基态铁原子的核外电子排布式为______, Fe3+有______个未成对电子。
(2)K3[Fe(CN)6]主要应用于照相纸、颜料、制革、印刷等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
①K3[Fe(CN)6]中所涉及的元素的第一电离能由大到小的顺序_________。
②(CN)2分子中存在碳碳键,则分子中σ键与π键数目之比为_________。KCN与盐酸作用可生成HCN,HCN的中心原子的杂化轨道类型为________。
(3)CO能与金属Fe所形成的配合物Fe(CO)5,其熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示:

①Fe(CO)5晶体类型属于__________晶体。
②关于Fe(CO)5,下列说法正确的是_________。
A Fe(CO)5是非极性分子,CO是极性分子
B Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C 1mol Fe(CO)5含有10mol配位键
D 反应Fe(CO)5 = Fe+5CO没有新化学键生成
(4)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示:
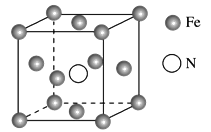
则氮化铁的化学式为________;设晶胞边长为a cm,阿伏加德罗常数的值为NA,该晶体的密度为________g·cm-3(用含a和NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置能达到实验目的的是
A |
| 淸洗铜与浓硫 酸反应后有残 液的试管 | B |
| 配置一定物质的量浓度的溶液实验中,为定容时的操作 |
C |
| 以淀粉为指示 剂,用酸式滴 定管盛放 Na2S2O3标准溶液进行滴定 | D |
| 装置为制备并用 排气法收集NO 气体的装置(稀硝酸+钢屑) |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A. 将CH3COONa溶液从20 ℃升温至30 ℃,溶液中c(CH3COO-)/[c(CH3COOH)c(OH-)]一定增大
B. 向0.1 mol·L-1的CH3COOH溶液中加入少量水溶液显碱性的物质,CH3COOH的电离程度一定增大
C. 向0.1 mol·L-1的NaHSO3溶液中加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3-)+c(OH-)+c(SO32-)
D. 可用浓度大于0.36 mol·L-1的Na2SO4溶液给钡离子中毒患者洗胃[已知Ksp(BaSO4)=1.1×10-10]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铁盐与亚硫酸盐之间的反应,某研究小组利用孔穴板进行了实验探究:

小组记最的实验现象如下表所示:
开始时 | 5min 后 | 3天后 | |
实验I | 溶液立即变为红褐色,比II、III中略浅 | 与开始混合时一致 | 溶液呈黄色,底部出现红褐色沉淀 |
实验II | 溶液立即变为红褐色 | 红褐色明显变浅 | 溶液呈黄绿色 |
实验III | 溶液立即变为红褐色 | 红褐色变浅,比II中深 | 溶液呈黄色 |
(1)测得实验所用0.4mol/LFeCl3溶液及Fe(NO3)3溶液pH均约为1.0。两溶液均呈酸性的原因是_______________(用离子方程式表示)。
(2)开始混合时,实验I中红褐色比II、III中略浅的原因是____________________________。
(3)为了探究5min后实验II、III中溶液红褐色变浅的原因,小组同学设计了实验IV;分别取少量 5min后实验I、II、III中溶液,加入2滴铁氰化钾溶液,发现实验II、III中出现蓝色沉淀,实验I中无明显变化。试用方程式解释溶液中出现Fe2+的原因______________________________。
(4)针对5min后实验III中溶液颜色比实验II中深,小组同学认为可能存在三种因素:
①Cl-可以加快Fe3+与SO32-的氧化还原反应:
②NO3-可以______________________________;
③NO3-在酸性环境下代替Fe3+氧化了SO32-,同时消耗H+,使Fe3+水解出的Fe(OH)3较多。
通过实验V和实验VI进行因素探究:
实验操作(己知Na+对实验无影响) | 5min后的现象 | |
实验V | 在2mLpH=1.0的0.4mol/L Fe(NO3)3溶液中溶解 固体,再加入2滴0.4mol/L Na2SO3溶液 | 溶液的红褐色介于II、III之间 |
实验VI | 在2mLpH=1.0的稀硝酸中溶解约0.19gNaNO3固体,再加 入2滴0.4mol/LNa2SO3溶液。向其中滴入少量BaCl2溶液 | _______________________。 |
实验结论:因素①和因素②均成立,因素③不明显。请将上述方案填写完整。
(5)通过上述时间,以下结果或推论合理的是_______________(填字母)。
a.Fe3+与SO32-同时发生水解反应和氧化还原反应,且水解反应的速率快,等待足够长时间后,将以氧化还原反应为主
b.浓度为1.2mol/L的稀硝酸在5min内不能将Fe2+氧化
c.向pH大于1的稀硝酸中加入少量Ba(NO3)2,使其完全溶解,可用来检验实验1的上层淸液中是否存在SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超分子在生命科学和物理学等领域中具有重要意义。由Mo将2个C60分子、2个p—甲酸丁酯吡啶及2个CO分子利用配位键自组装的超分子结构如图所示。
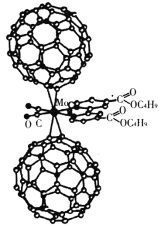
(1)Mo处于第五周期第VIB族,核外电子排布与Cr相似,它的基态价电子排布式是________;核外未成对电子数是________个。
(2)该超分子中配体CO提供孤电子对的原子是________(填元素符号),p—甲酸丁酯吡啶配体中C原子的杂化方式有________。(已知吡啶可看做苯分子中的一个CH原子团被N取代的化合物)
(3)已知:C60分子中存在碳碳单、双键;C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;C60分子只含有五边形和六边形;多面体的顶点数V、面数F及棱边数E遵循欧拉定理:V+F-E=2。则一个C60分子的结构是由_____个五边形和____个六边形组成的球体。用文字简述C60跟F2在一定条件下反应所得的物质的组成:__________________。
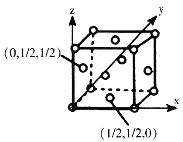
(4)已知:某晶胞中各原子的相对位置可用如图所示的原子坐标表示,其中所有顶点的原子坐标均可以为(0,0,0)。钼(Mo)的一种立方晶系的晶体结构中,每个晶胞有2个Mo原子,其中Mo原子坐标是(0,0,0)及(![]() ,
,![]() ,
,![]() )。根据以上信息,推断该晶体的原子堆积方式是_____________。已知该晶体的密度是ρg·cm-3,Mo的摩尔质量是Mg·mol-1,阿伏加德罗常数是NA,晶体中距离最近的Mo原子核之间的距离为_____pm。
)。根据以上信息,推断该晶体的原子堆积方式是_____________。已知该晶体的密度是ρg·cm-3,Mo的摩尔质量是Mg·mol-1,阿伏加德罗常数是NA,晶体中距离最近的Mo原子核之间的距离为_____pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高聚物L:是一种来源于生物学灵感的新型粘合剂。下列关于高聚物L的说法中,不正确的是
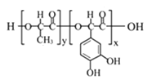
A. 单体之一为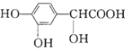
B. 在一定条件下能发生水解反应
C. 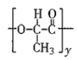 的结构中不含酯基
的结构中不含酯基
D. 生成1mol L的同时,会有(x+y-1)mol H2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高聚物的结构片断如下:
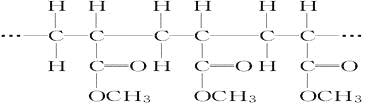
下列分析正确的是( )
A. 它是缩聚反应的产物B. 其单体是CH2=CH2和HCOOCH3
C. 其链节是CH3CH2COOCH3D. 其单体是CH2=CHCOOCH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com