
| 0.1mol |
| 3mol/L |


科目:高中化学 来源: 题型:阅读理解
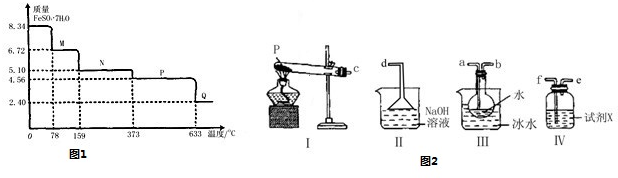
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:海门市2007学年第一学期高三第一次诊断考试、化学试卷 题型:022
| |||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室欲配制90mL浓度为1.00mol·L-1的Na2CO3溶液:
(1)配制时的实验步骤为:计算、称量、溶解、转移(洗涤)、 ▲ 、摇匀;
(2)本实验中必须用到的仪器有托盘天平、药匙、玻璃棒、烧杯、量筒、胶头滴管、
▲ (注明所需仪器的规格)。
(3)某同学欲称量Na2CO3的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。烧杯的实际质量为 ▲ g,要完成本实验该同学应称出 ▲ g Na2CO3。
(4)使用容量瓶前必须进行的一步操作是 ▲ 。
(5)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)
①没有洗涤烧杯和玻璃棒 ▲ ;②容量瓶不干燥,含有少量蒸馏水 ▲ ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com