
在化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中属于这种情况的是
①过量的锌与18mol/L硫酸溶液反应
②过量的氢气与少量的N2在催化剂存在下充分反应
③浓盐酸与过量的MnO2
④过量的铜与浓硫酸
⑤过量银与稀硝酸
⑥过量的稀盐酸与块状石灰石
A.①④⑤ B.②③⑤ C.②③④ D.①②③④⑤
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015-2016学年湖南师大附属中学高二上二次阶段测化学卷(解析版) 题型:选择题
将浓度为0.1mol·L-1 HF溶液加水不断稀释,下列各量始终保持增大的是
A.c(H+) B.Ka(HF) C. 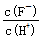 D.
D. 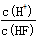
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高一上12月月考化学试卷(解析版) 题型:选择题
人的胃液是一种强酸性液体,pH在0.9~1.5之间,氢氧化铝是一种治疗胃液过多的胃药的主要成分,目前这种胃药已不常用,原因主要是
A.长期摄人铝元素不利于人体健康
B.它不能中和胃液
C.它不易溶于胃液
D.它的疗效太差
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津静海一中高一上12月学业调研化学卷(解析版) 题型:选择题
全世界每年铜的产量为8×106t,工业上由辉铜矿(主要成分是Cu2S,其中铜元素为+1价)生产铜的主要反应为:Cu2S+O2 2Cu+SO2下列说法正确的是
2Cu+SO2下列说法正确的是
A.该反应中Cu2S只是还原剂
B.每生产1molCu需转移2mol电子
C.该反应中SO2既是氧化产物又是还原产物
D.若用该反应生产铜,全世界每年产生的SO2的体积为1.4×106L
查看答案和解析>>
科目:高中化学 来源:2016届天津市高三上12月学业调研化学试卷(解析版) 题型:填空题
回答下列问题:
(1)已知两种同素异形体A、B的燃烧热的热化学方程式为:
A(s)+O2(g)= CO2(g) △H=-393.51kJ/mol
B(s)+O2(g)= CO2(g) △H=-395.41kJ/mol
则两种同素异形体中较稳定的是(填“A”或“B”) 。
(2)工业上用H2和Cl2反应制HCl,各键能数据为:H-H:436kJ/mol,Cl-Cl:243kJ/mol,H-Cl:431kJ/mol。该反应的热化学方程式是 。
(3)合成气(CO和H2为主的混合气体)不但是重要的燃料也是重要的化工原料,制备合成气的方法有多种,用甲烷制备合成气的反应为:
①2CH4(g)+O2(g) 2CO(g)+4H2(g);ΔH1=-72 kJ·mol-1
2CO(g)+4H2(g);ΔH1=-72 kJ·mol-1
②CH4(g)+H2O(g) CO(g)+3H2(g);ΔH2=+216 kJ·mol-1
CO(g)+3H2(g);ΔH2=+216 kJ·mol-1
氢气与氧气反应生成水蒸气的热化学方程式为 。
现有1 mol由H2O(g)与O2组成的混合气,且O2的体积分数为x,将此混合气与足量CH4充分反应。
若x=0.2时,反应①放出的能量为 kJ。
若x= 时,反应①与②放出(或吸收)的总能量为0。
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三上学期1月月考理综化学试卷(解析版) 题型:实验题
3-丁酮酸乙酯在有机合成中用途极广,广泛用于药物合成,还用作食品的着香剂。其相对分子质量为130,常温下为无色液体,沸点 181℃,受热温度超过95℃摄氏度时就会分解;易溶于水,与乙醇、乙酸乙酯等有机试剂以任意比混溶;实验室可用以乙酸乙酯和金属钠为原料制备。乙酸乙酯 相对分子质量为88,常温下为无色易挥发液体,微溶于水,沸点77℃。
【反应原理】

【实验装置】

【实验步骤】
1.加热反应:向反应装置中加入32 mL(28.5g,0.32mol)乙酸乙酯、少量无水乙醇、1.6 g(0.07mol)切细的金属钠,微热回流1.5~3小时,直至金属钠消失。
2.产物后处理:冷却至室温,卸下冷凝管,将烧瓶浸在冷水浴中,在摇动下缓慢的加入32 mL 30%醋酸水溶液,使反应液分层。用分液漏斗分离出酯层。酯层用5%碳酸钠溶液洗涤,有机层放入干燥的锥形瓶中,加入无水碳酸钾至液体澄清。
3.蒸出未反应的乙酸乙酯:将反应液在常压下蒸馏至100℃。然后改用减压蒸馏,得到产品2.0g。
回答下列问题:
(1)从反应原理看,无水乙醇的作用是 。
(2)反应装置中加干燥管是为了 。两个装置中冷凝管的作用 (填“相同”或“不相同”),冷却水进水口分别为 和 (填图中的字母)。
(3)产物后处理中,滴加稀醋酸的目的是 ,稀醋酸不能加多了,原因是 。用分液漏斗分离出酯层的操作叫 。碳酸钠溶液洗涤的目的是 。加碳酸钾的目的是 。
(4)采用减压蒸馏的原因是 。
(5)本实验所得到的3-丁酮酸乙酯产率是 (填正确答案标号)。
A.10% B.22% C.19% D.40%
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期期末理综化学试卷(解析版) 题型:选择题
下面表格中的实验操作、实验现象和结论均正确且相符的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸只表现脱水性 |
B | 将盐酸滴入Na2CO3溶液中 | 有气泡产生 | 氯的非金属性比碳强 |
C | 向某溶液中加入浓NaOH溶液并加热, 在试管口用湿润的红色石蕊试纸检验 | 试纸变蓝 | 原溶液中含有NH4+ |
D | SO2通入Ba(NO3)2溶液中 | 不会产生白色沉淀 | BaSO3 溶于酸 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一上12月月考化学试卷(解析版) 题型:填空题
下图为某套实验装置示意图,其中加热装置和部分药品等均已经省略(装置①和装置②为气体发生装置)。
(1)甲同学利用如图1所示装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO2并验证其性质。装置①用于实验室制备NH3,用装置②制备过量O2.装置①中发生反应的化学方程式是__________________________;B处冰水冷却的U型管中有红棕色气体生成且越接近U型管底部颜色越浅,请写出有关反应的化学方程式_________________________;
(2)SO3常温下是液体,16.8℃以下是无色或白色晶体。乙同学利用此套装置合成SO3,其反应为2SO2+O2 2SO3,B处冰水冷却的U型管中的固体出现.C中若盛放K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是_________________________;(生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进_________________________(从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明)
2SO3,B处冰水冷却的U型管中的固体出现.C中若盛放K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是_________________________;(生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进_________________________(从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明)
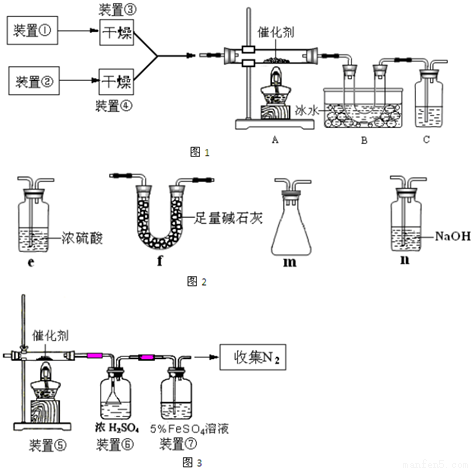
(3)丙同学采用图3所示装置拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制NO和NH3),将上述装置A、B、C分别换成下列⑤、⑥、⑦。
请回答:装置⑦的作用可能是__________________________;若进入装置⑤的NO共22.4L(已折算为标准状况,下同),氨气过量,最后收集到标准状况下11.2L N2,则NO的转化率(转化率=已转化的量/原来的总量)是______________(能正确表达出计算过程即可)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古巴彦淖尔一中高二上期中化学试卷(解析版) 题型:选择题
某学生的实验报告所列出的下列数据中合理的是
A.用10 mL量筒量取7.13 mL稀盐酸
B.用托盘天平称量25.20 g NaCl
C.用25 mL滴定管做中和滴定实验时,用去某浓度的碱溶液21.70 mL
D.用广泛pH试纸测得某溶液的pH为2.3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com