
| A、MgO |
| B、SiO2 |
| C、CuO |
| D、铁粉 |
| 16×2 |
| 55+16×2 |
| 16×2 |
| 55+16×2 |
| 16 |
| 24+16 |
| 16×2 |
| 28+16×2 |
| 16 |
| 16+64 |


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
| A、根据红外光谱图的分析可以初步判断有机物中具有哪些基团 |
| B、实验室制乙炔的反应是氧化还原反应 |
| C、“神州七号”的防护层中含聚四氟乙烯,聚四氟乙烯属于不饱和烃 |
| D、用酸性高锰酸钾溶液除去乙炔中含有的H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丝绸与棉布(采用灼烧闻其气味的方法) |
| B、Na2SO4与NH4Cl(采用加碱加热闻其气味的方法) |
| C、NaCl与KCl(采用灼烧时观察焰色的方法) |
| D、K2CO3与K2SO4(采用加BaCl2观察有无沉淀产生的方法) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | ||
| SO2 | O2 | Ar | ||
| 甲 | 2 | 1 | 0 | 放出热量:Q1 |
| 乙 | 2 | 1 | 0 | 放出热量:Q2 |
| 丙 | 2 | 1 | 0.5 | 放出热量:Q3 |
| A、Q1=Q3<Q2 |
| B、达到平衡时,乙容器中SO2的体积分数最大 |
| C、平衡时,甲、乙、丙3个容器中甲的平衡常数最小 |
| D、若在上述条件下,反应生成1mol SO3(s),则反应放热为98.5kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阴极:2H++2e-=H2↑ 阳极:4OH--4e-=2H2O+O2↑ |
| B、阴极:2H++2e-=H2↑ 阳极:2Cl--2e-=Cl2↑ |
| C、阴极:Cu2++2e-=Cu 阳极:4OH--4e-=2H2O+O2↑ |
| D、阴极:Cu2++2e-=Cu 阳极:2Cl--2e-=Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
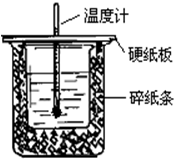 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.
某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com