
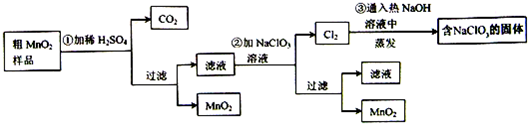
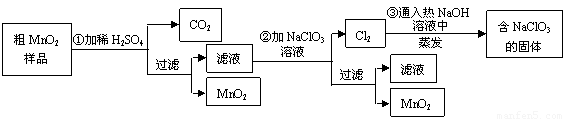
MnO2��һ����Ҫ�������ܲ��ϣ���MnO2���ᴿ�ǹ�ҵ��������Ҫ���ڡ�ij�о���ѧϰС������˽���MnO2�����н϶��MnO2��MnCO3����Ʒת��Ϊ��MnO2ʵ�飬���������£�
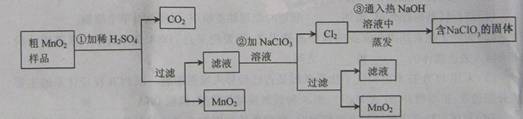
��1���ڢٲ���ϡH2SO4ʱ����MnO2��Ʒ�е� ��д��ѧʽ��ת��Ϊ���������ʡ�
��2���ڢڲ���Ӧ�����ӷ���ʽ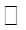 +
+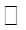 ClO3+
ClO3+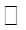 ��
��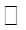 MnO2��3+
MnO2��3+ ��
��
��3���ڢ۲������������������������̨������Ȧ���� �� �� ����֪�����õ��Ĺ�������NaClO3��NaOH����һ�����к��� ��д��ѧʽ����
��4������MnO2��Ʒ������Ϊ12.69g���ڢٲ���Ӧ�����˵õ�8.7g MnO2�����ռ���0.224LCO2����״�����أ������ڵڢڲ���Ӧ��������Ҫ mol NaClO3
 ˫��ͬ������ѵ��ϵ�д�
˫��ͬ������ѵ��ϵ�д� �Ƹ�С״Ԫͬ������������ϵ�д�
�Ƹ�С״Ԫͬ������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��8�֣�MnO2��һ����Ҫ�������ܲ��ϣ���MnO2���ᴿ�ǹ�ҵ��������Ҫ���ڡ�ij�о���ѧϰС������˽���MnO2�����н϶��MnO��MnCO3����Ʒת��Ϊ��MnO2��ʵ�飬���������£�
��1���ڢٲ���ϡH2SO4ʱ����MnO2��Ʒ�е� ��д��ѧʽ��ת��Ϊ���������ʡ�
��2���ڢڲ���Ӧ�����ӷ���ʽ�ǣ�
�� ClO3���� �� MnO2���� Cl2���� ��
��3���ڢ۲������������������������̨������Ȧ���� �� ����������
��4������MnO2��Ʒ������Ϊ12��69g���ڢٲ���Ӧ�����˵õ�8��7g MnO2�����ռ���0��224LCO2����״���£������ڵڢٲ���Ӧ��������Ҫ mol H2SO4��
����֪Ħ��������MnO2 -87g/mol�� MnO-71g/mol�� MnCO3-115 g/mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012���Ϻ����ɽ����и�����ѧ�����п��Ի�ѧ�Ծ� ���ͣ���ѡ��
MnO2��һ����Ҫ�������ܲ��ϣ���MnO2���ᴿ�ǹ�ҵ��������Ҫ���ڡ�ij�� ����ѧϰС������˽���MnO2�����н϶��MnO��MnCO3����Ʒת��Ϊ��MnO2��ʵ�飬���������£�
����ѧϰС������˽���MnO2�����н϶��MnO��MnCO3����Ʒת��Ϊ��MnO2��ʵ�飬���������£�
��֪�ڢ� ����Ӧ�����ӷ���ʽΪ��5Mn2+ + 2ClO3- + 4H2O �� 5MnO2�� + Cl2��
����Ӧ�����ӷ���ʽΪ��5Mn2+ + 2ClO3- + 4H2O �� 5MnO2�� + Cl2�� + 8H+
+ 8H+
����������ɵ�41~46�⣺
41���ڢٲ���ϡH2SO4ʱ����MnO2��Ʒ�е� ��д��ѧʽ��ת��Ϊ������ ���ʡ�
���ʡ�
42��д���ڢ۲���Ӧ�Ļ�ѧ����ʽ  ��
��
43��ʵ��������ɵڢ۲������������������������̨������Ȧ���� �� ����������
44���������п���ѭ��ʹ�õ������� ��
45������MnO2��Ʒ������Ϊ12.69g���ڢٲ���Ӧ�����˵õ�8.7g MnO2�����ռ���0.224 L CO2����״���£������ڵڢٲ���Ӧ��������Ҫ mol H2SO4��
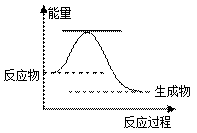
46����֪2H2O2(l) �� 2H2O(l) ��O2(g)����Ӧ���̵������仯��ͼ��ʾ��
 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ���㽭ʡ����Ϫ���и�����ѧ������������ѧ�Ծ� ���ͣ������
(12��)MnO2��һ����Ҫ�������ܲ��ϣ���MnO2���ᴿ�ǹ�ҵ��������Ҫ���ڡ�ij�о���ѧϰС������˽���MnO2�����н϶��MnO��MnCO3����Ʒת��Ϊ��MnO2ʵ�飬���������£�
��1���ڢٲ���ϡH2SO4ʱ����MnO2��Ʒ�е� ��д��ѧʽ��ת��Ϊ���������ʡ�
��2���ڢڲ���Ӧ�����ӷ���ʽ
 +
+ ClO3��+
ClO3��+ ��
�� MnO2+
MnO2+ Cl2��+
Cl2��+ ��
��
��3���ڢ۲������������������������̨������Ȧ���� �� �� ����֪�����õ��Ĺ�������NaClO3��NaOH����һ�����к��� ��д��ѧʽ����
��4������MnO2��Ʒ������Ϊ12.69g���ڢٲ���Ӧ�����˵õ�8.7g MnO2�����ռ���0.224LCO2����״���£������ڵڢڲ���Ӧ��������Ҫ mol NaClO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�꽭��ʡ��ͨ�и�����ѧ�����п��Ի�ѧ�Ծ� ���ͣ������
��20�֣�MnO2��һ����Ҫ�Ĺ��������ϣ���MnO2���ᴿ�ǹ�ҵ��������Ҫ���ڡ�ij�о���ѧϰС������˽���MnO2��ֻ���н϶��MnO��MnCO3����Ʒת��Ϊ��MnO2��ʵ�飬���������£�
��1���ڢٲ���ϡH2SO4ʱ������MnO2��Ʒ�� �� ���� ��д��ѧʽ��ת��Ϊ���������ʡ�
��2���ڢڲ���Ӧ�����ӷ���ʽ�ǣ�������������ƽ���� Mn2+ �� ClO3���� �� MnO2���� Cl2���� ��
��3���ڢ۲������������������������̨������Ȧ���� �� �� �� ����������
��4������MnO2��Ʒ������Ϊ12.69g���ڢٲ���Ӧ�����˵õ�8.7g MnO2�����ռ���0.224LCO2����״���£������ڵڢٲ���Ӧ��������Ҫ�� mol H2SO4��д��������� ����֪Ħ��������MnO2 -87g/mol�� MnO-71g/mol�� MnCO3-115 g/mol��
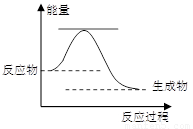
��5����֪2H2O2��l����2H2O��l����O2��g�� ��H��a kJ��mol-1 ��Ӧ���̵������仯��ͼ��ʾ����
�� �÷�ӦΪ �� ��Ӧ������ȡ����ȡ�����
��������������ͼ�л���ʹ��MnO2������������·�Ӧ��������ϵ�����仯ʾ��ͼ��
 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com