
分析 n(NaCl)=$\frac{100g×87.75%}{58.5g/mol}$=1.5mol,n(H2SO4)=0.05435L×$\frac{1000×1.84×98%}{98}$mol/L=1mol,结合反应及m=nM计算.
解答 解:n(NaCl)=$\frac{100g×87.75%}{58.5g/mol}$=1.5mol,n(H2SO4)=0.05435L×$\frac{1000×1.84×98%}{98}$mol/L=1mol,由NaCl(s)+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HCl↑可知,NaCl过量,1molH2SO4反应生成1molHCl,则生成HCl的质量为1mol×36.5g/mol=36.5g,
答:生成HCl为36.5g.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应、物质的量关系、物质的量的相关计算公式为解答的关键,侧重分析与计算能力的考查,注意过量判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
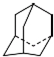 ,用一个氯原子与一个溴原子取代后形成的二元取代物数目为( )
,用一个氯原子与一个溴原子取代后形成的二元取代物数目为( )| A. | 8 | B. | 7 | C. | 6 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ③④⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定只含有离子键 | |
| B. | 单质分子中均存在化学键 | |
| C. | 仅含有共价键的化合物一定是共价化合物 | |
| D. | 由不同种非金属元素的原子形成的共价化合物一定只含极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠、二氧化硫属于氧化物,而次氯酸属于弱酸,臭氧属于单质 | |
| B. | 它们都能使品红溶液褪色,但褪色原理不同;加热褪色的溶液都能变红 | |
| C. | 二氧化硫能与其他三种物质发生氧化还原反应,二氧化硫表现还原性 | |
| D. | 过氧化钠溶于水产生的气体与臭氧互为同素异形体,臭氧比氧气活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=10-4 mol•L-1的溶液中:NH4+、K+,SO42-,NO3- | |
| B. | 无色溶液中:Na+,Cu2+,Cl-,NO3- | |
| C. | 0.1mol•L-1 AgNO3溶液中:H+,K+,SO42-,I- | |
| D. | 饱和氯水中:Cl-,Na+,NO3-,SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com