
 根据图回答问题.
根据图回答问题.
| ||
| ||
| ||
| ||


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:

| c4(NO)?c6(H2O) |
| c4(NH3)?c5(O2) |
| c4(NO)?c6(H2O) |
| c4(NH3)?c5(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
请根据下图回答问题:
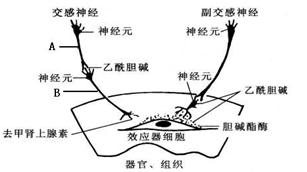
(1)神经调节的基本方式是____________,它的结构基础是 ,兴奋从图中的A通过 (结构)传递到B,A和B的遗传物质相同,释放的物质不同,其根本原因是 。
(2)去甲肾上腺素释放后 (能或不能)被胆碱酯酶分解,原因是 。
(3)已知某些神经元含有NO合成酶。中枢神经系统中的NO可弥散到另一神经元发挥其生理作用,并起到神经元间信息传递的作用。那么NO相当于一种__________。如果破伤风杆菌可阻止神经末梢释放甘氨酸,因而引起肌肉痉挛和惊厥。由此可见甘氨酸能使下一个神经元_______________(填“兴奋”或“抑制”)
查看答案和解析>>
科目:高中化学 来源:2013年吉林省延边州安图县长白山一中高考化学二轮复习试卷(一)(解析版) 题型:解答题
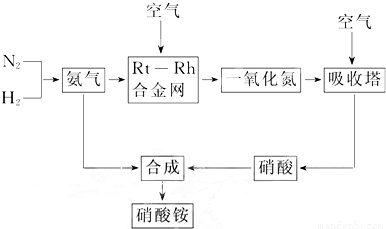
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com