

分析 (1)开发较经济且资源可持续利用的制氢气方法要从能源消耗分析;
(2)催化剂能降低反应活化能;
(3)利用盖斯定律解答,从待求反应出发分析反应物、生成物在所给反应中的位置,通过相互加减可得;
(4)①根据电池总反应:2H2+O2=2H2O可知:通入氢气的一极为电池的负极,发生氧化反应,反应为H2-2e-═2H+,通入氧气的一极为电池的正极,发生还原反应,反应为O2+4e-+4H+=2H2O;
②n(H2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,根据负极反应式H2-2e-═2H+计算转移电子数;根据2PbSO4+2H2O=Pb+PbO2+2H2SO4计算产生H2SO4的物质的量,阳极是PbSO4失去电子生成PbO2、SO42-、H+,发生氧化反应.
解答 解:(1)A.电解水需要大量的电能,不符合廉价的要求,故A错误;
B.锌和稀硫酸反应,消耗大量的锌和硫酸,不符合廉价的要求,故B错误;
C.光解海水,可充分利用光能,廉价而又低碳,符合要求,故C正确;
D.天然气不是可持续能源,故D错误;
故答案为:C;
(2)催化剂能降低反应活化能,所以b曲线使用催化剂,a曲线没有使用催化剂,
故答案为:a;
(3)①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kmol-1
②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.4kJmol-1
据盖斯定律,①×2-②得:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=165.0kmol-1,
故答案为:+165.0;
(4)①通入氧气的一极为电池的正极,发生还原反应,电极反应式为O2+4e-+4H+=2H2O,
故答案为:O2+4e-+4H+=2H2O;
②n(H2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,根据负极反应式H2-2e-═2H+可知转移电子为0.1mol×2=0.2mol;
给铅蓄电池充电时发生2PbSO4+2H2O=Pb+PbO2+2H2SO4,每生成2个H2SO4,转移电子数为2个,当转移0.2mol电子时,生成0.2mol电子;
阳极是PbSO4失去电子生成PbO2、SO42-、H+,发生氧化反应,阳极电极反应式为PbSO4+2H2O-2e-=PbO2+SO42-+4H+,
故答案为:0.2;0.2;PbSO4+2H2O-2e-=PbO2+SO42-+4H+.
点评 本题考查较为综合,涉及化学反应能量的计算,原电池和电解池的工作原理以及电极反应式的书写,题目难度中等,注意把握原电池电极反应式的书写方法.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | amol | B. | bmol | C. | (3a-b)mol | D. | (a+b)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径由大判小的顺序;Z>R>Y>W | |
| B. | X与Y形成化合物中一定含有离子键,可能含有共价键 | |
| C. | Y的氢化物比R的氢化物稳定,但Y的氢化物比R的氢化物熔沸点低 | |
| D. | RY2、WY2通入BaCl2溶液中均有白色沉淀生成. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 300℃下,将2mol SO21mol O2混合于2L的恒容密闭容器中,发生反应:2SO2(g)+O2(g)?2SO3(g)△H,2分钟末达到平衡,测得SO2的转化率为60%,请根据化学反应的有关原理回答下列问题:
300℃下,将2mol SO21mol O2混合于2L的恒容密闭容器中,发生反应:2SO2(g)+O2(g)?2SO3(g)△H,2分钟末达到平衡,测得SO2的转化率为60%,请根据化学反应的有关原理回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由反应①知H2O2的氧化性比Fe3+强,由反应②知H2O2的还原性比Fe2+强 | |
| B. | 在反应①、②中H2O2均作氧化剂被还原 | |
| C. | 在H2O2分解过程中,Fe2+和Fe3+的总量保持不变 | |
| D. | H2O2生产过程要严格避免混入Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
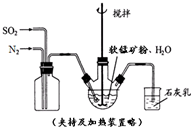 高纯MnCO3是制备高性能磁性材料的主要原料.某化学小组在实验室模拟用软锰矿(主要成分MnO2,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
高纯MnCO3是制备高性能磁性材料的主要原料.某化学小组在实验室模拟用软锰矿(主要成分MnO2,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
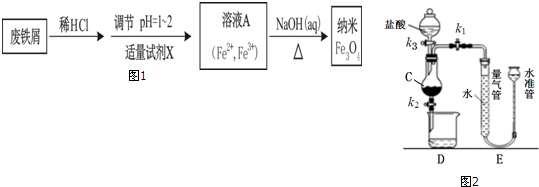
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①③②④ | C. | ②①④③ | D. | ①④②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com