
分析 (1)1molCH3OH燃烧生成CO2和液态水时放热akJ×32=32kJ,结合物质的状态书写热化学方程式;
(2)Ⅰ、C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1;
Ⅱ、2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
Ⅲ、TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g)△H=+141kJ•mol-1
由盖斯定律计算Ⅰ×2-Ⅱ+Ⅲ得到;
(3)①6Ag(s)+O3(g)═3Ag2O(s)△H=-235.8kJ•mol-1,
②2Ag2O(s)═4Ag(s)+O2(g)△H=+62.2kJ•mol-1,
由盖斯定律可知①×2+②×3,得到2O3(g)=3O2(g),以此来解答.
解答 解:(1)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热akJ.32g甲醇燃烧生成二氧化碳和液态水放出热量为32QKJ;表示甲醇燃烧热的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-32akJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-32akJ•mol-1;
(2)Ⅰ、C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1;
Ⅱ、2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
Ⅲ、TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g)△H=+141kJ•mol-1
由盖斯定律计算Ⅰ×2-Ⅱ+Ⅲ得到:TiO2(s)+2C(s)+2Cl2(g)=TiCl4(s)+2CO(g)△H=-80 kJ/mol,
故答案为:-80 kJ/mol;
(3)①6Ag(s)+O3(g)═3Ag2O(s)△H=-235.8kJ•mol-1,
②2Ag2O(s)═4Ag(s)+O2(g)△H=+62.2kJ•mol-1,
由盖斯定律可知①×2+②×3,得到2O3(g)=3O2(g),△H=(-235.8kJ•mol-1)×2+(+62.2kJ•mol-1)×3=-255kJ/mol,
则O3转化为O2的热化学方程式为2O3(g)=3O2(g)△H=-255kJ/mol,
故答案为:2O3(g)=3O2(g)△H=-255kJ/mol.
点评 本题考查热化学方程式的书写,为高频考点,把握热化学方程式的书写方法、盖斯定律的应用为解答的关键,侧重分析与应用能力的考查,注意物质的状态、焓变,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
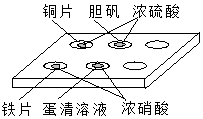 在如图所示的实验中,对点滴板上的现象描述正确的是( )
在如图所示的实验中,对点滴板上的现象描述正确的是( )| A. | ①④ | B. | ②③ | C. | ①⑤ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{A+n}$mol | B. | $\frac{a}{A}$mol | C. | $\frac{(A-N+m)a}{A+m}$mol | D. | $\frac{a}{A}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+Br2(g)?2HBr(g) | B. | N2(g)+3H2(g)?2NH3(g) | C. | 2SO2(g)+O2(g)?2SO3(g) | D. | C(s)+CO2(g)?2CO(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| B. | 取用细口瓶里的试液时,先拿下瓶塞,倒放在桌上,然后标签朝外拿起瓶子,瓶口要紧挨着试管口,将液体缓缓地倒入试管 | |
| C. | 胶头滴管取完一种试液后,可直接取另一种不与其反应的试液 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=l的溶液中:Na+、I-、NO3-、SO42- | |
| B. | 氢氧化铁胶体中:H+、K+、Cl-、S2- | |
| C. | 在pH=0的溶液中:Na+、NH4+、CH3COOH、Cl- | |
| D. | 水电离产生的c(H+)=1×10-12mol•L-1的溶液中:HCO3-、NH4+、Cl-、Ca2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com