
【题目】已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。用0.1 mol·L-1NaOH溶液滴定20mL0.1mol·L-1H2SO3溶液的滴定曲线如图所示(曲线上的数字为pH)。下列说法正确的是( )
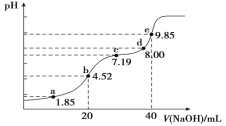
A.a点所得溶液中:2c(HSO3-)+c(SO32-)=0.1 mol/L
B.b点所得溶液中:c(H+)+c(SO32-)=c(OH-)+c(H2SO3)
C.c点所得溶液中:c(Na+)>3c(HSO3-)
D.d点所得溶液中:c(Na+)>c(OH-) >c(SO32-)
【答案】C
【解析】
A、 a点溶液pH= 1.85, 即pH= pKa1,所以溶液中c(H2SO3)= c(HSO3-),根据物料守恒:c(SO32-)+( HSO3-)+c(H2SO3)=![]() ,由于c(H2SO3)= c(HSO3-),所以2c(HSO3-)+c(SO32-)=
,由于c(H2SO3)= c(HSO3-),所以2c(HSO3-)+c(SO32-)=![]() ,故A错误;
,故A错误;
B,b点加入KOH溶液的体积为20mL,恰好反应生成NaHSO3,根据质子守恒:c(H+) + c(H2SO3)= c(SO32-)+c(OH-),故B错误;
C、c点溶液pH= 7.19, 即pH= pKa2,所以溶液中c(HSO3-)= c(SO32-),溶液为碱性,溶液中c(H+)<c(OH- ),溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH- )+c(HSO3-) + 2c(SO32-),由于c(HSO3- ) = c(SO32-), 所以c(Na+)+c(H+)=c(OH-) + 3 c(HSO3-),又由于c(H+)< c(OH-),所以c(Na+)> 3 c(HSO3-),故C正确;
D、d点加入NaOH溶液体积为40mL,恰好反应生成Na2SO3,Na2SO3水解,水解是微弱的,故c(SO32-)>c(OH-) ,故D错误;
答案选C。


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:
【题目】铁单质及其化合物在生活、生产中应用广泛。请回答下列问题:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为___________________。
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是________________________________________________________________________。
(3)硫酸铁可作絮凝剂,常用于净水,其原理是______________________________(用离子方程式表示)。在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降而除去,其原因是______________________________。
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是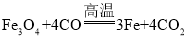 ,若有1.5mol Fe3O4参加反应,转移电子的物质的量是__________。
,若有1.5mol Fe3O4参加反应,转移电子的物质的量是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛在木材加工、医药等方面有重要用途。
I.利用甲醇(CH3OH)制备甲醛
脱氢法:CH3OH(g)HCHO(g)+H2(g) △H1=+92.09kJ·mol-1
氧化法:CH3OH(g)+1/2O2(g)HCHO(g)+H2O(g) △H2
(1)脱氢法制甲醛,有利于提高平衡产率的条件有____________。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)已知:2H2(g)+O2(g)=2H2O(g) △H3=-483.64kJ·mol-1,则△H2=________。
(3)750K下,在恒容密闭容器中,充入一定量的甲醇,发生反应CH3OH(g)HCHO(g)+H2(g),若起始压强为101kPa,达到平衡转化率为50.0%,则反应的平衡常数Kp=__________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
(4)Na2CO3是甲醇脱氢制甲醛的催化剂,有研究指出,催化反应的部分机理如下:
历程i:CH3OH→·H+·CH2OH
历程ⅱ:·CH2OH→·H+HCHO
历程ⅲ:·CH2OH→3·H+CO
历程iv:·H+·H→H2
如图所示为在体积为1L的恒容容器中,投入1molCH3OH,在碳酸钠催化剂作用下,经过5min反应,测得甲醇的转化率(X)与甲醛的选择性(S)与温度的关系(甲醛的选择性:转化的CH3OH中生成HCHO的百分比),回答下列问题:
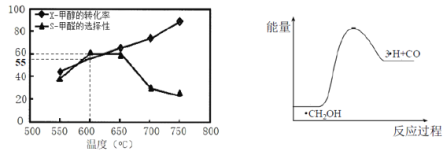
①600℃时,5min内甲醛的反应速率为____________。
②650℃-750℃甲醛选择性随温度下降,而甲醇转化率随温度升高的可能原因为________;
③700℃时,历程iii能量~反应过程如图所示,在答卷纸上绘制历程ii的“能量~反应过程”示意图。___________
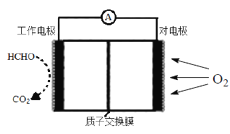
II.室内甲醛超标会危害人体健康,通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理所示,则工作电极的电极反应式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的甲烷和氨气相比较,下列结论中错误的是( )
A.两种气体的分子个数之比为17∶16
B.同温同压下,两种气体的体积之比为17∶16
C.两种气体的氢原子个数之比为17∶12
D.同温同压下,两种气体的密度之比为17∶16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.用浓盐酸分别和MnO2、KClO3反应制备1mol氯气,转移的电子数均为2NA
B.标准状况下,3.36LHF和3.36LNH3所含的电子数、质子数均为1.5NA
C.标准状况下,76g 3H2O2中含有6NA共价键
D.0.1molL-1MgCl2溶液中含有的Mg2+数目一定小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为1molSO2Cl2(g)和1molSCl2(g)反应生成SOCl2(g)过程中的能量变化示意图,已知E1=xkJmol﹣1、E2=ykJmol﹣1, 下列有关说法中正确的是( )
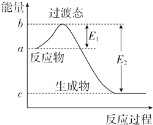
A.反应的活化能等于ykJmol﹣1
B.若对反应体系加热,△H不变
C.若在反应体系中加入催化剂,E1不变
D.1 molSO2Cl2(g)和1molSCl2(l)反应生成SOCl2(g)的△H=(x﹣y)kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
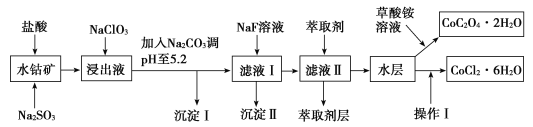
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3目的是___。
(2)NaClO3在浸出液中发生反应的离子方程式为___。
(3)加入Na2CO3调pH至5.2,目的是___;萃取剂层含锰元素,则沉淀Ⅱ的主要成分为__。
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,___、__、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O的含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是___(回答一条原因即可)。
(6)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为____。[已知:CoC2O4·2H2O的摩尔质量为183g·mol1]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际计量大会第26届会议修订了阿伏加德罗常数(NA=6.02214076×1023mol-1),于2019年5月2日正式生效。设NA是阿伏加德罗常数的值,下列说法正确的是
A.40g正丁烷和18 g异丁烷的混合物中共价键数目为13NA
B.常温常压下,124 g P4中所含P—P键数目为4NA
C.电解精炼铜时,阳极质量减小3.2g时,转移的电子数为0.1NA
D.0.1mol FeCl3完全水解转化为氢氧化铁胶体,生成胶粒数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,W溶液中加入KSCN出现血红色。
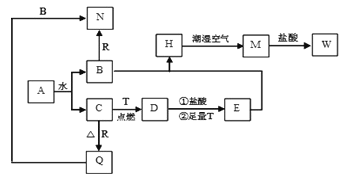
(1)写出下列物质的化学式:A:_____;E:______。
(2)B与E混和得到H并在潮湿空气中变成M的过程中,可能观察到的现象:_______。
(3)按要求写方程式:B和R反应生成N的离子方程式:____________;M→W的离子方程式:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com