
| A. | C2H6 | B. | C2H6O | C. | C2H4O | D. | C3H6 |
分析 燃烧后生成一氧化碳,说明氧气不足,有机物与氧气均没有剩余,浓硫酸增重为水的质量,碱石灰增重为二氧化碳的质量,根据质量守恒定律可知一氧化碳的质量,再根据原子守恒计算2.3gA中氧原子物质的量,根据有机物A中C、H、O的原子个数比确定最简式,结合最简式解答.
解答 解:生成水的物质的量为$\frac{2.7g}{18g/mol}$=0.15mol,生成二氧化碳的物质的量为$\frac{2.2g}{44g/mol}$=0.05mol,
n(O2)=$\frac{2.8L}{22.4L/mol}$=0.125mol,m(O2)=0.125mol×32g/mol=4g,
根据质量守恒定律可得:m(有机物)+m(O2)=m(CO)+m(CO2)+m(H2O),
则:m(CO)=2.3g+4g-2.7g-2.2g=1.4g,CO物质的量为$\frac{1.4g}{28g/mol}$=0.05mol,
根据氧原子可得2.3gA中O原子的物质的量为0.05mol×2+0.05mol+0.15mol-0.125mol×2=0.05mol,
有机物A中C原子总物质的量为0.05mol+0.05mol=0.1mol,H原子总物质的量为0.15mol×2=0.3mol,
故有机物A中N(C):N(H):N(O)=0.1mol:0.3mol:0.05mol=2:6:1,则有机物A的最简式C2H6O,H原子已经达到饱和,则分子式为C2H6O,
故选:B.
点评 本题考查有机物分子式的确定,侧重于学生的分析计算能力的考查,注意根据守恒法确定最简式,最简式中H原子已经达到饱和碳的四价结构,则最简式即为分子式.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+ 比B- 少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数.R是由A、D两元素形成的离子化合物,其中A+ 与D2- 离子数之比为2:1.请回答下列问题:
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+ 比B- 少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数.R是由A、D两元素形成的离子化合物,其中A+ 与D2- 离子数之比为2:1.请回答下列问题: ,在CB3 分子中C元素原子的原子轨道发生的是sp3 杂化.
,在CB3 分子中C元素原子的原子轨道发生的是sp3 杂化.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 伴有能量变化的物质变化都是化学变化 | |
| C. | 放热反应的发生无需任何条件 | |
| D. | 在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
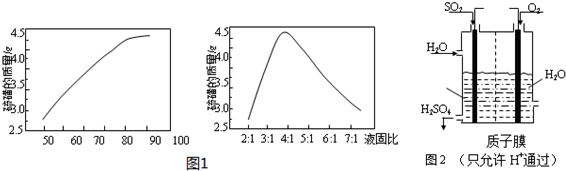
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 试剂 | 分离方法 | |
| ① | 溴苯(溴) | 氢氧化钠溶液 | 分液 |
| ② | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
| ③ | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
| ④ | Cl2(HCl) | 饱和NaCl溶液 | 洗气 |
| A. | ①③ | B. | ①④ | C. | 只有 ④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
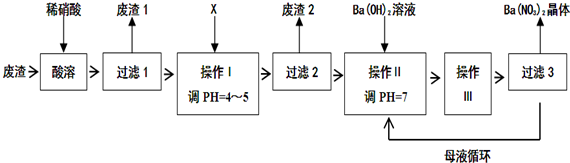
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
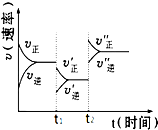 如图是可逆反应A(g)+2B(g)?2C(g)+3D(g),(正反应△H<0)的化学反应速率与化学平衡随外界条件改变而变化的关系图,下列条件的改变与图中情况相符的是( )
如图是可逆反应A(g)+2B(g)?2C(g)+3D(g),(正反应△H<0)的化学反应速率与化学平衡随外界条件改变而变化的关系图,下列条件的改变与图中情况相符的是( )| A. | t1时,降低了温度 | |
| B. | t2时,加了催化剂 | |
| C. | t2时,增大了压强 | |
| D. | t1时,减小了A或B的物质的量的浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com