
【题目】如图是利用废铜屑(含杂质)制备胆矾(硫酸铜晶体)的过程 
已知:
溶液中被沉淀的离子 | Fe3+ | Fe2+ | Cu2+ |
完全生成氢氧化物的沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
请回答:
(1)下列物质中最适宜做氧化剂X的是 (填字母).
A.NaClO
B.H2O2
C.KMnO4
(2)加入试剂①是为了调节pH,试剂①可以选择(填化学式).
(3)操作①的名称是 .
(4)沉淀D加入盐酸可以得到FeCl3溶液,关于FeCl3溶液的性质中说法不正确的是 .
A.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B.向FeCl3溶液滴加NaOH溶液,出现红褐色沉淀
C.将FeCl3溶液滴加NaOH溶液,将沉淀干燥灼烧,得到Fe(OH)3固体
D.向FeCl3溶液中滴加KSCN溶液,溶液变为红色
(5)沉淀D加入盐酸和铁粉,可以制得FeCl2溶液,实验室保存FeCl2溶液,需加入过量的铁粉防止FeCl2溶液变质,其原因是(用离子方程式表示).
【答案】
(1)B
(2)CuO或CuCO3或Cu(OH)2
(3)蒸发结晶
(4)C
(5)Fe+2Fe3+=3Fe2+
【解析】解:由制备实验流程可知,Fe和Cu灼烧,铜与氧气反应生成CuO,Fe与空气不反应,加入稀硫酸,反应生成硫酸铜和硫酸亚铁,硫酸亚铁会部分氧化硫酸铁,为了除去二价铁,由完全生成氢氧化物沉淀时,溶液的pH可知需将二价铁氧化生成三价铁,然后调节pH形成沉淀,过滤除去氢氧化铁沉淀,滤液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥可得胆矾,(1)氧化剂X的作用为将亚铁离子氧化为铁离子,且不引入新杂质,只有B符合,故答案为:B;(2)试剂①是为了调节pH,且不能引入新杂质,试剂①可以选择CuO或CuCO3或Cu(OH)2 , 故答案为:CuO或CuCO3或Cu(OH)2;(3)操作①从溶液中得到晶体,名称是蒸发结晶,故答案为:蒸发结晶; (4)A.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,为胶体分散系,则该液体能产生丁达尔效应,故A正确;B.向FeCl3溶液滴加NaOH溶液,出现红褐色沉淀为氢氧化铁,故B正确;C.将FeCl3溶液滴加NaOH溶液,将沉淀Fe(OH)3干燥灼烧,得到Fe2O3固体,故C错误;D.向FeCl3溶液中滴加KSCN溶液,溶液变为红色,发生络合生成生成络离子,故D正确;故答案为:C;(5)保存FeCl2溶液,需加入过量的铁粉防止FeCl2溶液变质,即防止亚铁离子被氧化,离子反应为Fe+2Fe3+=3Fe2+ , 故答案为:Fe+2Fe3+=3Fe2+ . 由制备实验流程可知,Fe和Cu灼烧,铜与氧气反应生成CuO,Fe与空气不反应,加入稀硫酸,反应生成硫酸铜和硫酸亚铁,硫酸亚铁会部分氧化硫酸铁,为了除去二价铁,由完全生成氢氧化物沉淀时,溶液的pH可知需将二价铁氧化生成三价铁,然后调节pH形成沉淀,过滤除去氢氧化铁沉淀,滤液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥可得胆矾,以此来解答.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】1814年戴维发现了一氯化碘(沸点97.4℃),是一种红棕色易挥发液体,它的性质与卤素相似,可用作强氧化剂。干燥的氯气与碘反应可以制备ICl ,请用下列装置来制备ICl。

回答下列问题:
(1)制备ICl时,各装置接口的连接顺序是__________。
(2)能否将装置B 中的饱和食盐水换成水______(填“能”或“不能“);请用平衡移动的观点解释其理由________________。
(3)D装置中的烧瓶需放在冷水中,其目的是____________。
(4)将D装置得到的液态产物进步提纯可得到较纯净的IC1,提纯采取的方法是___________。
(5)ICl 与冷的NaOH稀溶液反应的离子方程式为______________。
(6)请设计实验证明IC1的氧化性比I2强:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应X+2Y=X2++2Y-的叙述中正确的是
A. X被氧化,Y是氧化剂 B. Y被还原,X是氧化剂,
C. X是还原剂,Y被氧化 D. Y被还原,X2+是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
主族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在③~⑦元素中,原子半径最大的是 , 其离子的原子结构示意图为
(2)写出⑤和⑨最高价氧化物对应水化物间发生反应的离子方程式: .
(3)按要求写出下列两种物质的电子式:①的单质;⑨的过氧化物;
(4)在⑦与⑩的单质中,化学性质较活泼的是 , 可用什么化学反应说明该事实(写出反应的化学方程式): .
(5)请用电子式表示④和⑩组成的化合物的形成过程 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述不正确的是( )
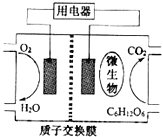
A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+6H2O-24e-=6CO2+24H+
C.放电过程中,质子(H+)从负极区向正极区迁移
D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当光束通过下列物质时,不会出现丁达尔效应的是
①稀豆浆 ②蒸馏水 ③硫酸铜稀溶液 ④FeCl3稀溶液 ⑤云雾
A.②④⑤B.①③④C.②③④D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ⑤ | |||||
3 | ③ | ⑥ | |||||
4 | ④ | ⑦ | |||||
(1)表中元素________(填写元素符号)的非金属性最强;元素________(填写元素符号)的金属性最强,写出它与水反应的离子方程式__________________________________。
(2)表中元素③的原子结构示意图是________。
(3)表中元素⑥、⑦氢化物的稳定性顺序为________>________(填写化学式,下同)。
(4)表中元素最高价氧化物对应水化物酸性最强的酸的分子式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,其熔点64.5℃,沸点5.5℃,遇水易水解。它是有机合成中的重要试剂,可由NO与Cl2在常温常压下合成。
(1)实验室制备原料气NO和Cl2的装置如下图所示:
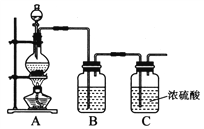
实验室制Cl2时,装置A中烧瓶内发生反应的化学方程式为_______。装置B中盛放的试剂为_______,其作用为___________________。
(2)将上述收集到的Cl2充入D的集气瓶中,按图示装置制备亚硝酰氯。

①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_______。
②装置D中发生的反应方程式为__________________。
③如果不用装置E会引起什么后果______________________。
④某同学认为装置F不能有效吸收尾气中的某种气体,该气体为_____,为了充分吸收尾气,可将尾气与_______同时通入氢氧化钠溶液中。
(3)工业上可用间接电化学法除去NO,其原理如下图所示,吸收塔中发生的反应为:NO+S2O42+H2O→N2+HSO3

①吸收塔内发生反应的氧化剂与还原剂物质的量之比为_________________。
②阴极的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为2AgCl+Mg= Mg2++2Ag+2Cl-,有关该电池说法错误的是
A.镁为电池负极B.有24g镁被氧化时,还原得到216g银
C.正极反应为Ag++e-=AgD.可用于海上应急照明
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com