
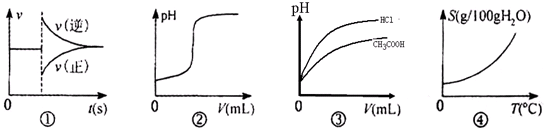
| A. | 图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| B. | 图②可以表示向一定量的氢氧化钠溶液中滴加一定浓度的稀硫酸时pH的变化 | |
| C. | 图③可以表示相同pH的醋酸和盐酸溶液分别加水稀释时溶液的pH随体积的变化 | |
| D. | 图④可以表示所有的固体物质溶解度随温度的变化 |
分析 A.改变温度瞬间正、逆速率都增大;
B.氢氧化钠溶液呈碱性,向一定量的氢氧化钠溶液中滴加一定浓度的稀硫酸,溶液pH逐渐增大;
C.醋酸是弱电解质,氯化氢是强电解质,醋酸中存在电离平衡,加水稀释促进醋酸电离;
D.氯化钠溶解度随温度的增大变化不大,氢氧化钙温度越高溶解度越小.
解答 解:A.图象中改变条件V(逆)增大、v(正)减小,改变温度瞬间正、逆速率都增大,故不可能表示改变温度后反应速率随时间的变化,故A错误;
B.氢氧化钠溶液呈碱性,向一定量的氢氧化钠溶液中滴加一定浓度的稀硫酸,溶液pH逐渐增大,图象与实际不相符,图象应为一定量的稀硫酸中滴加一定量氢氧化钠溶液,故B错误;
C.醋酸是弱电解质,氯化氢是强电解质,醋酸中存在电离平衡,加水稀释等PH的醋酸和盐酸,pH变化大的是盐酸,变化小的是醋酸,故C正确;
D.氯化钠溶解度随温度的增大变化不大,氢氧化钙溶解度随温度而降低,故D错误;
故选C.
点评 本题以图象形式考查反应速率影响因素、中和滴定、化学反应图象、溶解度,较为综合,题目难度中等.


科目:高中化学 来源: 题型:实验题
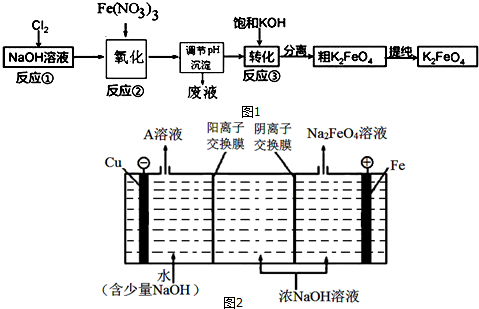
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
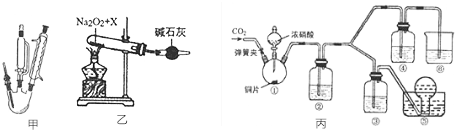
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯为纯净物;聚乙烯为混合物 | |
| B. | 等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 | |
| C. | 乙烯的化学性质比聚乙烯活泼 | |
| D. | 乙烯和聚乙烯都能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的物质的量浓度 | B. | 混合气体的压强 | ||
| C. | 混合气体总物质的量 | D. | v(C)与v(D)的比值 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
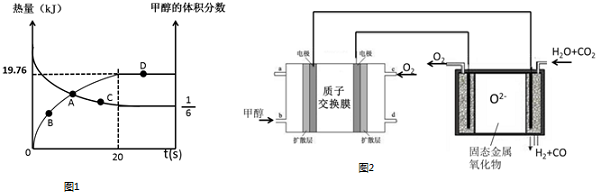
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com