
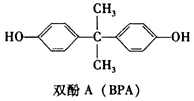
| A. | 双酚A分子的核磁共振谱有4组峰 | |
| B. | 双酚A分子中所有的碳原子可能共平面 | |
| C. | 1mol双酚A最多可与2molBr2反应 | |
| D. | 双酚A与足量H2反应的产物属于芳香醇 |
分析 A.有机物中有几种氢原子,则其核磁共振氢谱有几组吸收峰;
B.该分子具有甲烷和苯的结构特点,苯中所有原子共平面,甲烷呈正四面体结构;
C.苯环上酚羟基的邻对位H原子能被溴取代;
D.双酚A和足量氢气加成后不存在苯环.
解答 解:A.该分子中有4种氢原子,则其核磁共振氢谱有4组吸收峰,故A正确;
B.该分子具有甲烷和苯的结构特点,苯中所有原子共平面,甲烷呈正四面体结构,所有该分子中所有C原子不可能共平面,故B错误;
C.苯环上酚羟基的邻对位H原子能被溴取代,所以1mol双酚A最多可与4molBr2发生取代反应,故C错误;
D.双酚A和足量氢气加成后不存在苯环,所以其加成后的产物不属于芳香醇,但属于醇,故D错误;
故选A.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析、判断及知识迁移能力,明确基本概念、官能团及其性质是解本题关键,注意酚和溴发生取代反应位置,易错选项是C.


科目:高中化学 来源: 题型:解答题
| 实验步骤 | 有关问题 |
| (1)计算所需NaOH的质量 | 需要NaOH的质量为4.0g |
| (2)称量NaOH固体 | 称量过程中主要用到的仪器是 托盘天平、药匙 |
| (3)将NaOH加入100mL烧杯中,加适量蒸馏水溶解 | 为加快溶解,可采取的措施是 搅拌、加热、研细氢氧化钠等措施 |
| (4)将烧杯中的溶液转移至500mL容量瓶中 | 为防止溶液溅出,应该采取的措施是 玻璃棒引流 |
| (5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是 加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质分子均不存在化学键 | |
| B. | 共价化合物中一定含有共价键,也可能含有离子键 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 离子化合物中一定含有离子键,也可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | HCOOH | HCN | H2S |
| 电离平衡常数(25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
| A. | 恰好中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者 | |
| B. | HCOO-、CN-、HS-在溶液中不可以大量共存 | |
| C. | NaHS溶液中加入适量KOH后:c(Na+)═c(H2S)+c(HS-)+2C(S2-) | |
| D. | 等体积、等浓度的HCOONa和NaCN两溶液中所含离子总数目HCOONa大于NaCN |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8g苯所含碳碳双键数目为0.3NA | |
| B. | 28g乙烯所含共用电子对数目为6NA | |
| C. | 标准状况下,11.2 L二氯甲烷所含分子数为0.5NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化物对应的水化物的酸性:b<c | |
| B. | 元素的非金属性次序为:c>b>a | |
| C. | d与其他3种元素均能形成离子化合物 | |
| D. | 含d元素的化合物的焰色反应呈紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
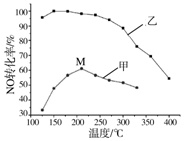 氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一.SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0
氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一.SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com