
| A. | 原子 | B. | 阴离子 | C. | 阳离子 | D. | 无法确定 |
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a-b}{V}$ mol•L-1 | B. | $\frac{2a-b}{V}$ mol•L-1 | C. | $\frac{2(a-b)}{V}$ mol•L-1 | D. | $\frac{2(2a-b)}{V}$ mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
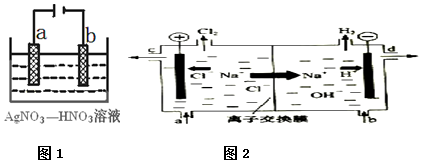
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al:1s22s22p63s2 | B. | O2-:1s22s22p6 | ||
| C. | Na+:1s22s22p63s1 | D. | Si:1s22s22p63s23p4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应的氧化剂与还原剂的物质的量之比为1:5 | |
| B. | 若有2 mol Fe2+被氧化,则被Fe2+还原的O2的物质的量为0.5 mol | |
| C. | 每生成1 mol Fe3O4,反应转移的电子为4 mol | |
| D. | O2是氧化剂,S2O32-与Fe2+是还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com