
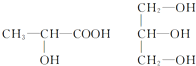 按要求完成下列问题.
按要求完成下列问题.分析 (1)Mg2+含有10个电子,核外电子排布式为1s22s22p6;
(2)根据配合物K3[Co(CN)6]结构分析中心离子为Co3+、配体为CN-、配位数为6;
(3)计算BCl3分子的中心原子B的价层电子对数,确定VSEPR模型和空间构型,杂化轨道数目和类型、根据空间构性确定键角;
(4)连接4个不同原子或原子团的碳原子为手性碳原子.
解答 解:(1)Mg2+含有10个电子,核外电子排布式为1s22s22p6,故答案为:1s22s22p6;
(2)根据配合物K3[Co(CN)6]结构分析,含有空轨道的金属阳离子为中心离子,所以中心离子为Co3+、有孤对电子的原子或离子为配体,所以配体为CN-、配位数就是配体的个数,所以配位数为6,
故答案为:Co3+;CN-;6;
(3)BCl3分子的中心原子B的价层电子对数=3+$\frac{1}{2}$(3-3×1)=3,孤电子对数为0,因此空间构型和VSEPR模型一致,为平面正三角形,因此键角为120°,杂化类型为sp2杂化,
故答案为:平面正三角形;sp2;120°.
(4)连接4个不同原子或原子团的碳原子为手性碳原子,所以手性碳原子分别为: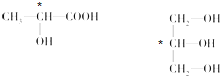 ,
,
故答案为: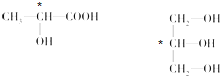 .
.
点评 本题考查了核外电子排布式(图)、配合物和分子结构,具有很强的综合性,难度中等,熟练掌握原子核外电子排布规律、价层电子对互斥理论和轨道杂化理论是解题的关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮的固定是指将氮元素由游离态转化为化合态的过程.
氮的固定是指将氮元素由游离态转化为化合态的过程.| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备溴苯的实验步骤如下:
实验室制备溴苯的实验步骤如下: +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr.
+HBr.| 苯 | 溴苯 | 对二溴苯 | |
| 密度/gcm-3 | 0.88 | 1.50 | 1.96 |
| 沸点/℃ | 80 | 156 | 220 |
| 水溶性 | 微溶 | 微溶 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p1${\;}^{2{2}^{3}}$③1s22s22p2④1s22s22p63s23p4 原子半径最大的是① | |
| B. | 具有下列价电子排布式的原子中,①3s23p1 ②3s23p 2 ③3s23p3 ④33s23p 4第一电离能最大是③ | |
| C. | ①Na、K、Rb ②N、P、Si ③Na、P、Cl,元素的电负性随原子序数增大而递增的是③ | |
| D. | 某主族元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703…,当它与氯气反应时生成的阳离子是X3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核外电子质量很小,在原子核外绕核作高速运动 | |
| B. | 核外电子的运动规律与普通物体不同,不能用牛顿运动定律来解释 | |
| C. | 在电子云示意图中,通常用小黑点来表示电子绕核作高速圆周运动 | |
| D. | 在电子云示意图中,小黑点越密表示电子在核外空间单位体积内电子出现的概率越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com