
【题目】在有机化学中有一种“吉利分子”C8H8O8,“吉利分子”C8H8O8可由X经如图所示转化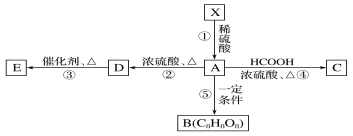
已知:①相同条件下,X与H2的相对密度为81,其中氧的质量分数约为49.4%,分子中氢、氧原子个数比为2∶1,X中没有支链;
②1 mol X在稀硫酸中发生反应生成2 mol甲醇和1 mol A;
③A中含有手性碳原子;
④D能使Br2的CCl4溶液褪色,E为高分子化合物,B为环状结构。
根据上述信息填空:
(1)X的分子式为______,A的分子中含有官能团的名称是______,E的结构简式为______;D若为纯净物,D的核磁共振氢谱存在________种吸收峰,面积比为________。
(2)写出B的一种含一个六元环的同分异构体的结构简式:____________________。
【答案】C6H10O5 羧基和羟基 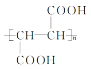 2 1∶1
2 1∶1 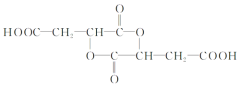
【解析】
根据题意,MX=81×2=162,O:(162×49.4)/16=5,H:10,C:(162105×16)/12=6,所以X的分子式为C6H10O5,结合信息②和反应④⑤知A中含有羟基和羧基,且A中含有手性碳原子,故A结构为HOOCCH2CH(OH)COOH,A发生消去反应生成D为HOOCCH═CHCOOH,E为D的加聚产物,E结构简式为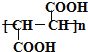 ,结合X的分子式及X生成A的条件可知,X为
,结合X的分子式及X生成A的条件可知,X为![]() ,B为环状化合物,含一个六元环的有机物B结构简式为
,B为环状化合物,含一个六元环的有机物B结构简式为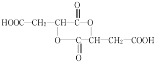 ,A与甲酸发生酯化反应生成C为
,A与甲酸发生酯化反应生成C为![]() 。
。
(1)X的分子式为 C6H10O5,A结构为HOOCCH2CH(OH)COOH,A的分子中含有官能团的名称是羧基和羟基,E的结构简式为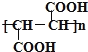 ;D为HOOCCH═CHCOOH,D的核磁共振氢谱存在2种吸收峰,面积比为1:1,故答案为:C6H10O5;羧基和羟基;
;D为HOOCCH═CHCOOH,D的核磁共振氢谱存在2种吸收峰,面积比为1:1,故答案为:C6H10O5;羧基和羟基;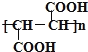 ;2;1:1;
;2;1:1;
(2) B为环状化合物,含一个六元环的有机物B结构简式为 ,故答案为:
,故答案为: 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是
A.新制氯水长时间放置颜色变浅
B.高压比常压更有利于 SO2 转化为 SO3
C.蒸干 AlCl3 溶液无法得到无水 AlCl3
D.滴加少量 CuSO4 溶液可以加快 Zn 与稀 H2SO4 反应的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好。(已知:2KMnO4+16HCl(浓)→2KCl+2MnCl2+5Cl2↑+8H2O)
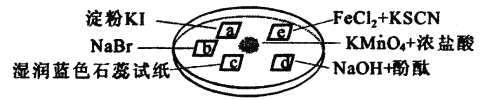
(1)b处的实验现象为___,d处的实验现象为_____。
(2)C处发生的离子方程式为____,其过程中包括___个平衡,通氯气对自来水进行杀菌消毒时,起主要作用的微粒是____。此微粒对水的电离平衡起到___“填促进”或“抑制”)作用。
(3)通过上述实验现象不能比较FeCl3与Br2氧化性的强弱,请设计实验比较两微粒氧化性的大小,并按要求回答下列问题:取___于试管中,滴加____,若溶液有____现象,说明___>___。
(4)二氧化氯(ClO2)在水处理领域有着广泛应用。与氯气相比,它不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。反应时,ClO2生成ClO2-、Cl-的转化率与溶液的pH的关系如图所示。则pH=8时,ClO2被还原为____。

(5)亚氯酸根离子(ClO2-)对人体不利,欲在弱碱性条件下将水中的ClO2-转化为Cl-除去。若该反应体系中的物质有:NaClO2、Fe(OH)3、NaHCO3、FeCl2、NaCl、H2O、CO2。写出并配平有关化学方程式,并标出电子转移的方向和数目:_____。ClO2更适合用于饮用水的消毒,其原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )

A. a和b都属于芳香族化合物
B. a和c分子中所有碳原子均处于同一平面上
C. a、b和c均能使酸性KMnO4溶液褪色
D. b和c均能与新制的Cu(OH)2反应生成红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现取![]() 铝镁合金,使其在一定浓度的稀硝酸中恰好完全溶解
铝镁合金,使其在一定浓度的稀硝酸中恰好完全溶解![]() 假定硝酸的还原产物只有
假定硝酸的还原产物只有![]() ,向反应后的混合溶液中滴加
,向反应后的混合溶液中滴加![]() 溶液,当滴加
溶液,当滴加![]() 时,得到沉淀的质量恰好为最大值
时,得到沉淀的质量恰好为最大值![]() ,则下列有关说法不正确的是
,则下列有关说法不正确的是![]()
![]()
A.沉淀中氢氧根离子的质量为![]() B.恰好溶解后溶液中的
B.恰好溶解后溶液中的![]() 的物质的量为
的物质的量为![]()
C.生成标准状况下NO气体的体积为![]() D.与合金反应的硝酸的物质的量为
D.与合金反应的硝酸的物质的量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯和溴取代反应的实验装置如图所示,其中A为由具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉。填写下列空白:

(1)向反应容器A中逐滴加入溴和苯的混合液,几秒内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):____________________________。
(2)B中NaOH溶液的作用是____________________。
(3)试管C中苯的作用是_______________________。
反应开始后,观察D和E两试管,看到的现象为____________________________,此现象可以验证苯和液溴的反应为____________(填反应类型)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应A+B→C(放热)分两步进行①A+B→X(吸热);②X→C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是______。
A.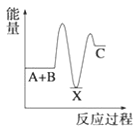 B.
B.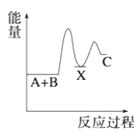
C.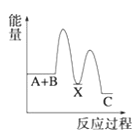 D.
D.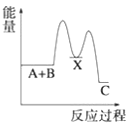
(2)①合成氨工业中,合成塔中每产生2molNH3,放出92.2kJ热量,已知(见图1):则1molN﹣H键断裂吸收的能量约等于______kJ。

②图2t2时刻改变的条件是______,t3时刻改变的条件是______。
③某温度下,若把10molN2与30molH2置于体积为10L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则氮气的转化率______。
④绝热恒容条件下,可以作为判断该反应达到平衡状态的依据是_____。
A.容器内气体的总压强保持不变
B.H2、N2的反应速率比为3∶1
C.容器内气体的平均摩尔质量保持不变
D.容器内气体的温度保持不变E.容器内气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,它们之间具有如图所示转化关系(反应条件及部分产物已略去)。下列有关物质的推断不正确的是( )

选项 | 假设 | 结论 |
A | 甲为Al(OH)3 | 丁可能是盐酸 |
B | 甲为Na2CO3溶液 | 戊可能是CO2 |
C | 甲为Fe | 丁可能是盐酸 |
D | 甲为N2 | 戊可能是氧气 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】36.5 g HCl气体溶解在1 L水中(水的密度为1 g·cm-3),所得溶液的密度为ρ g·cm-3,质量分数为w,物质的量浓度为c,NA表示阿伏加德罗常数的数值,下列叙述中正确的是
A.所得溶液的物质的量浓度:c=1 mol·L-1B.所得溶液中含有NA个HCl分子
C.36.5 g HCl气体占有体积为22.4 LD.所得溶液的溶质质量分数:w=![]() ×100%
×100%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com