
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法不正确的是
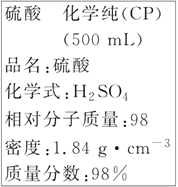
A.包装箱上应贴上腐蚀性液体的危险品标志图标
B.1 mol Al与足量该硫酸反应产生3 g氢气
C.配制90 mL 4.6 mol·L-1的稀硫酸需取该硫酸25 mL
D.配制500 mL 4.6 mol·L-1的稀硫酸时,定容时仰视刻度线导致浓度偏小
 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
A. KClO3发生还原反应
B. H2C2O4在反应中被氧化
C. H2C2O4的氧化性强于C1O2的氧化性
D. 每1mol C1O2生成,该反应转移的电子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是由4个碳原子结合成的6种有机物(氢原子没有画出)
a. 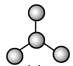 b.
b.  c.
c. ![]() d.
d. ![]() e.
e.  f.
f. 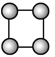
(1)写出有机物a的系统命名法的名称________。
(2)有机物a有一种同分异构体,试写出其结构简式_________。
(3)上述有机物中与c互为同分异构体的是________(填代号)。
(4)任写一种与e互为同系物的有机物的结构简式___________。
(5)上述有机物中不能与溴反应并使其褪色的有_______(填代号)。
(6)abcd四种物质中,4个碳原子一定处于同一平面的有___(填代号)。
(7)c通入酸性KMnO4溶液中观察到的现象是_______,发生了_________反应。
(8)e通入溴的CCl4溶液中观察到的现象是_________,发生了________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列比较正确的是( )
A. 第一电离能:I1(Na)>I1(Cl) B. 原子半径:r(C)>r(N)
C. 能级能量:E(2s)>E(3s) D. 电负性:O原子>F原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密度为d g·cm-3的溶液V mL含有摩尔质量为M的溶质m g,其物质的量浓度为c mo/L,质量分数为W%,下列表示式不正确的是
A.W%=![]() %B.d=
%B.d=![]() C.c=
C.c=![]() D.m=
D.m=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
(1) 已知H3PO2是一元弱酸,写出H3PO2电离方程式:_________________________________,NaH2PO2是___盐(填“正盐、酸式盐或碱式盐”)。
(2)熔融NaHSO4的电离方程式:_______________________________________ ;
(3) 中国自古有“信口雌黄”“雄黄入药”之说。雌黄As2S3和雄黄As4S4都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。砷元素有+2、+3两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。
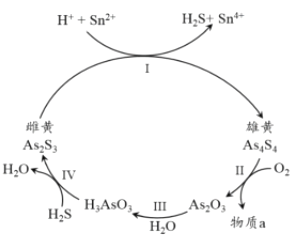
①以上转换关系图中发生的Ⅰ、Ⅱ、Ⅲ、Ⅳ反应,属于氧化还原反应的是___________.
②用双线桥法表示反应Ⅰ中的电子转移方向和数目:_________________________.
③假设物质转化率为100%,若Ⅱ中有0.1 mol As4S4反应,转移2.8 mol 电子,则标准状况下消耗O2的体积为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Ⅰ.太阳能、风能发电逐渐得到广泛应用,在发电系统中安装储能装置有助于持续稳定供电,其构造的简化图如下
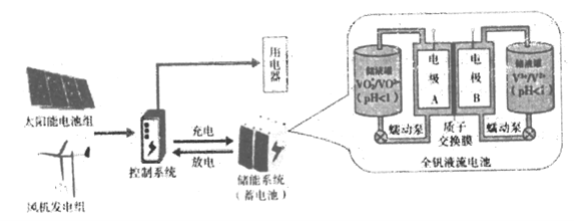
下列说法中,不正确的是________ (填字母序号)
a.太阳能、风能都是清洁能源
b.太阳能电池组实现了太阳能到电能的转化
c.控制系统能够控制储能系统是充电还是放电
d.阳光或风力充足时,储能系统实现由化学能到电能的转化
(2)全钒液流电池是具有发展前景的、用作储能系统的蓄电池。已知放电时V2+发生氧化反应,则放电时电极A的电极反应式为________ 。
(3)含钒废水会造成水体污染,对含钒废水(除VO2+外,还含有Al3+, Fe3+)等进行综合处理可实现钒资源的回收利用,流程如下:
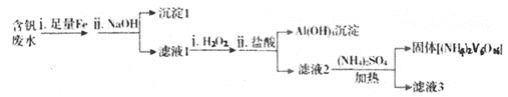
已知溶液pH范围不同时,钒的存在形式如下表所示
钒的化合价 | pH<2 | pH>11 |
+4价 | VO2+, VO(OH)+ | VO(OH)3- |
+5价 | VO2+ | VO43- |
①加入NaOH调节溶液pH至13时,沉淀1达最大量,并由灰白色转变为红褐色,用化学用语表示加入NaOH后涉及到氧化物还原反应的化学反应方程式为________。
②向碱性的滤液1(V的化合价为+4)中加入H2O2的作用是________ 。
(4)Ⅱ.氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在。某工厂处理氨氮废水的流程如下:
![]()
Ⅰ中加入NaOH溶液,调pH=11并鼓入大量空气,用离子方程式表示加NaOH溶液的作用是________;鼓入大量空气的目的是________。
(5)Ⅱ中加入适量NaClO溶液,控制pH在6~7,将氨氮转化为无毒物质,过程Ⅱ发生3个反应:
ⅰ.ClO-+H+=HClO
ⅱ.NH4++HClO=NH2Cl+H++H2O(NH2Cl中Cl元素为+1价)
ⅲ. ……
已知:水体中以+1价形式存在的氯元素有消毒杀菌的作用,被称为“余氯”。下图为NaClO加入量与“余氯”含量的关系示意图。其中氨氮含量最低的点是c点。

b点表示的溶液中氮元素的主要存在形式是(用化学式表示) ________;反应ⅲ的化学方程式是________。
(6)Ⅲ中用Na2SO3溶液处理含余氯废水,要求达标废水中剩余Na2SO3的含量小于5mg·L-1。若含余氯废水中NaClO的含量是7.45mg·L-1,则处理10m3含余氯废水,至多添加10%Na2SO3溶液________kg(溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列物质间反应的离子反应方程式:
(1)NaHSO4溶液与NaHCO3溶液混合:___。
(2)将NaHSO4与Ba(OH)2在溶液中按物质的量之比1∶1混合:___。
(3)向20mL0.3mol/L的Ca(HCO3)2溶液中加入20mL0.3mol/L的NaOH溶液,反应的离子方程式:__;继续加入10mL0.3mol/L的NaOH溶液,反应的离子方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表前四周期部分,针对表中的①~⑨9种元素,用化学用语填写下列空白:
① | ② | ③ | |||||||||||||||
④ | ⑤ | ⑥ | ⑦ | ⑧ | |||||||||||||
⑨ | |||||||||||||||||
(1)①~⑨中,单质化学性质最不活泼的是__________,最高价氧化物对应的水化物的酸性最强的是__________。
(2)②、③、④的简单离子按离子半径从小到大排列顺序为_________________。
(3)④在③单质中燃烧的产物的电子式为_________________。
(4)⑤的原子结构示意图为________,从原子结构分析,④比⑤活泼的原因是_________。
(5)②和⑦形成一种化合物分子,各原子均达到8电子稳定结构,则该化合物的化学式为_________________。
(6)②、③的最简单氢化物中,沸点较高的是_____________。
(7)②的简单氢化物与②的最高价氧化物的水化物溶液反应的化学方程式为:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com