
【题目】培养学生的学科素养是高中化学新课程的总目标,探究式课堂的教学由于注重知识的形成过程而很好地体现了新课改的理念。某班在学习“过氧化钠的性质”时,做了如下两个实验:
实验一:向盛有少量Na2O2固体的试管中滴入一定量的水,立即把带火星的木条放在试管口,检验生成的气体。用手轻轻摸一下试管外壁,然后向反应后的溶液中滴入酚酞溶液。观察到木条复燃,管壁微热,加入酚酞后溶液变红,马上又褪色。
针对该实验过程,很多学生对反应原理及反应过程提出了许多问题,如为何溶液变红色又褪色,其原因是什么?实验现象也不能给予正确的解释,为解决此疑问,我们组织化学活动小组同学查阅了有关资料并做了一些实验加以探究。
Ⅰ.探究反应的原理:①Na2O2溶于水电离出Na+和O22- ,O22- 与H2O电离出的H+结合生成H2O2,②H2O2再分解释放出O2。
(1)请写出与该反应原理中的两个方程式:①__________________________②__________;
Ⅱ. 探究褪色的原理
通过资料查阅后,溶液先变红是因为生成NaOH,之后再褪色是因为H2O2的作用(已知H2O2具有氧化性,酸性)。化学活动小组的同学们猜想H2O2是如何使溶液褪色的,提出了两个假设。
(2)假设甲:反应生成的中间产物H2O2具有酸性,中和了NaOH使溶液褪色。
假设乙:___________________________________________________。
(3)为了验证这两个假设到底哪一个正确的,同学们设计了一组实验来研究这个问题。通过以下实验证明假设乙是正确的。
实验步骤 | 实验现象 | 实验结论 | |
实验1 | 取少量NaOH溶液于试管中,加 入酚酞溶液变红,再加入少量30% | ①______________ |
|
实验2 | 在实验1的溶液中加入适量的NaOH溶液 | ②______________ | 使红色褪去的原因是双氧水的氧化性 |
实验二:石棉网上面有一个棉花团(内含适量浅黄色固体粉末),点燃后,导出CO2气体吹向棉花团,发现棉花团剧烈燃烧。
(4)结合所学知识分析棉花团剧烈燃烧的原因主要是:_______________________________;
请写出相关的化学反应方程式:_____________________________________。
【答案】Na2O2+2H2O=2NaOH+H2O2 2HO=2HO+O↑ 反应生成的中间产物H2O2具有氧化性,使溶液褪色 溶液红色褪去 溶液的红色没有恢复 Na2O2和CO2反应放出热量,生成的氧气具有助燃性,让棉花燃烧起来 2Na2O2+2CO2=2Na2CO3+O2
【解析】
(1)根据题意过氧化钠先与水发生复分解反应生成过氧化氢和NaOH,反应的方程式为![]() ;后过氧化氢发生分解反应生成H2O和O2,反应的化学方程式为
;后过氧化氢发生分解反应生成H2O和O2,反应的化学方程式为![]() ;
;
(2)根据题意,过氧化氢具有酸性和氧化性,因此另一个假设应该就是![]() 具有的强氧化性导致了溶液褪色;
具有的强氧化性导致了溶液褪色;
(3)根据实验1结论,既然![]() 能使碱性溶液中变红色的酚酞溶液褪色,则实验现象①应该为“溶液红色褪去”;又因为实验2结论明确了H2O2的氧化性才是溶液褪色的原因,所以向褪色后的溶液中加入NaOH溶液不会显红色,故现象②为“溶液的红色没有恢复”;
能使碱性溶液中变红色的酚酞溶液褪色,则实验现象①应该为“溶液红色褪去”;又因为实验2结论明确了H2O2的氧化性才是溶液褪色的原因,所以向褪色后的溶液中加入NaOH溶液不会显红色,故现象②为“溶液的红色没有恢复”;
(4)根据燃烧的三个条件:棉花为可燃物,那么氧气和热量一定就是![]() 和
和![]() 反应时提供的;相关的反应方程式为2Na2O2+2CO2=2Na2CO3+O2。
反应时提供的;相关的反应方程式为2Na2O2+2CO2=2Na2CO3+O2。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】被称之为“软电池”的纸质电池,其电池总反应为Zn+2MnO2+H2O![]() ZnO+2MnO(OH)。下列说法正确的是( )
ZnO+2MnO(OH)。下列说法正确的是( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当65 g Zn完全溶解时,流经电极的电子为1mol
D.电池正极反应式为2MnO2+2e-+2H2O![]() 2MnO(OH)+2OH-
2MnO(OH)+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是合成一种天然茋类化合物的重要中间体,其合成路线如下:

(1)A中含氧官能团的名称为________和________。
(2)A→B的反应类型为________。
(3)C→D的反应中有副产物X(分子式为C12H15O6Br)生成,写出X的结构简式:________。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应;
②碱性水解后酸化,含苯环的产物分子中不同化学环境的氢原子数目比为1∶1。
(5)已知: (R表示烃基,R'和R"表示烃基或氢),写出以
(R表示烃基,R'和R"表示烃基或氢),写出以 和CH3CH2CH2OH为原料制备
和CH3CH2CH2OH为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。________________________
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取Fe、FeO、Fe2O3的均匀混合物质量为7.2g,向其中加入200 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出1120 mL(标准状况)的气体。所得溶液中,加入KSCN溶液无血红色出现,那么若用足量的CO在高温下还原相同质量的此混合物,能产生铁的质量为 ( )
A. 1.4g B. 2.8g C. 5.6g D. 11.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL稀溶液中只含有Fe3+、Cu2+、H+、NO3-四种离子,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的质量的关系如图所示,若整个反应过程中溶液的体积不发生变化,则下列说法中不正确的是
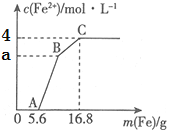
A. 原溶液的c(H+)=4mol·L—1
B. 若a=3,则原溶液中c(Cu2+)=1mol·L—1
C. 原溶液中的c(NO3-)=7mol·L-1
D. BC段发生反应的离子方程式为Cu2++Fe=Fe2++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气因含有少量H2S等气体开采应用受限。T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是
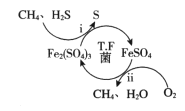
A. 该脱硫过程需要不断添加Fe2(SO4)3溶液
B. 脱硫过程O2间接氧化H2S
C. 亚铁是血红蛋白重要组成成分,FeSO4可用于治疗缺铁性贫血
D. 《华阳国志》记载“取井火煮之,一斛水得五斗盐”,我国古代已利用天然气煮盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法合理的是
①根据纯净物中是否含氧元素,来判断是否属于氧化物
②根据电泳现象可证明胶体带电荷
③直径介于lnm~l00nm之间的微粒称为胶体
④金属氧化物都是碱性氧化物
⑤根据分散系的稳定性将分散系分为胶体、溶液和浊液
⑥同一钢笔使用不同牌号的墨水容易堵塞,是由于胶体的聚沉
A. 只有⑥ B. 只有②⑥ C. 只有③④⑤ D. 只有①②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A~H是中学化学中的常见物质,A、C、G是金属,E、F是氧化物, B溶于水得蓝色溶液,E为红棕色粉末,它们有如下图所示的关系(反应中生成的水已略去)。

试回答下列问题。
(1)推断填写物质化学式:A是________ ,E是_________,H是_________。
(2)F的类别是_________(选填“酸性氧化物”、“碱性氧化物”或“两性氧化物”)。
(3)反应④的化学方程式为___________________________________。若反应④转移电子数目为4NA,则生成F______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)含有相同碳原子数的CO和CO2,其质量比为________。
(2)标准状况下有①44.8L CH4,②9.03×1023个NH3分子,③85g H2S三种气体,这三种气体的物质的量从大到小的顺序是________。
(3)若1g CO2中含有x个原子,则阿伏加德罗常数可表示为________。
(4)4.9g H2SO4含________个H2SO4分子,能和________mol NaOH完全反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com