
(10分)(1)已知25℃时,1 g H2在氧气中完全燃烧生成液态水,放出热量142.9kJ。写出该反应的热化学方程式:__________________。
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,用多孔石墨作电极,在电极上分别吹入氢气和氧气。写出负极的电极反应式:_________________________。
该电池工作一段时间后正极区附近溶液的pH值将______(填:变大、变小或不变)。
(3)在相同条件下,1 mol H2直接燃烧产生的能量与设计成燃料电池产生的能量______(填:直接燃烧多、燃料电池多、一样多)。
(4)氢气是一种十分理想的清洁能源,目前还面临着储运中因沸点太低难以液化的问题,请简述氢气沸点很低的原因_____________________。
(1)2H2(g)+O2(g)===2H2O(1) ΔH=-571.6kJ·mol-1(其它合理的答案也给分)
(2)H2+2OH--2e-===2H2O 变大 (3)一样多
(4)氢气的相对分子质量小,分子间作用力小,故沸点低。
解析:(1)考查热化学方程式的书写。1 g H2在氧气中完全燃烧生成液态水,放出热量142.9kJ,则1mol氢气燃烧放出的热量是142.9kJ×2=285.8Kj,所以热化学方程式为2H2(g)+O2(g)===2H2O(1) ΔH=-571.6kJ·mol-1(其它合理的答案也给分)
(2)在原电池中负极是失去电子,发生氧化反应的。所以氢气通入负极,电极反应式为H2+2OH--2e-===2H2O。氧气通入正极,电极反应式为O2+2H2O +4e-===4OH-,所以正极区域pH增大。
(3)根据能量守恒可知,1 mol H2直接燃烧产生的能量与设计成燃料电池产生的能量是相同的。
(4)氢气形成的晶体是分子晶体,相对分子质量很小,因此分子间作用力很小,所以沸点很低。


科目:高中化学 来源: 题型:
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (Ka) |
7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
| c(H+) |
| c(HF) |
| c(OH-) |
| c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
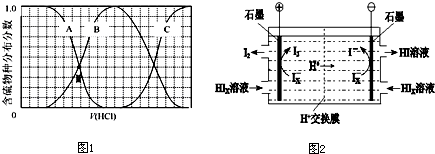
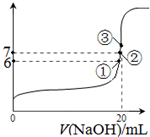
| 1 |
| x |
| 3 |
| x |
查看答案和解析>>
科目:高中化学 来源:2013届河北省高二上学期期中考试化学试卷(解析版) 题型:填空题
(8分)(1)已知25℃时弱电解质电离平衡常数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为:
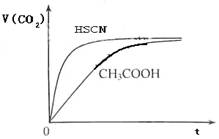
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ,
反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,将pH=1的H2SO4溶液a mL与pH=12的NaOH溶液b mL混合后,所得溶液的pH=3,则a:b= ;反应后,溶液中各离子浓度由大到小的顺序是 。
查看答案和解析>>
科目:高中化学 来源:2014届浙江省高一下学期期中考试化学试卷(解析版) 题型:填空题
(10分)(1)已知25℃时,1 g H2在氧气中完全燃烧生成液态水,放出热量142.9kJ。写出该反应的热化学方程式:__________________。
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,用多孔石墨作电极,在电极上分别吹入氢气和氧气。写出负极的电极反应式:_________________________。
该电池工作一段时间后正极区附近溶液的pH值将______(填:变大、变小或不变)。
(3)在相同条件下,1 mol H2直接燃烧产生的能量与设计成燃料电池产生的能量______(填:直接燃烧多、燃料电池多、一样多)。
(4)氢气是一种十分理想的清洁能源,目前还面临着储运中因沸点太低难以液化的问题,请简述氢气沸点很低的原因_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com