
| A. | 用标准的盐酸溶液滴定含甲基橙的氢氧化钠溶液,终点时溶液由黄色变成橙色 | |
| B. | 将二氧化硫通入氯化钡溶液中产生白色沉淀,再滴加稀硝酸沉淀不消失 | |
| C. | 向葡萄糖溶液中加入新制氢氧化铜,加热至沸腾,静置后上层溶液呈红色 | |
| D. | 海水提取溴的过程不发生氧化还原反应 |
分析 A.甲基橙的变色范围是pH<3.1的变红,pH>4.4的变黄,3.1-~4.4的呈橙色;
B.二氧化硫通入氯化钡溶液中,弱酸不能制强酸,不反应;
C.新制氢氧化铜中加入葡萄糖溶液反应生成红色沉淀;
D.溴离子变为溴单质为氧化还原反应;
解答 解:A.甲基橙的变色范围3.1~4.4,大于4.4为黄色,而盐酸滴定氢氧化钠时是由碱性到中性,PH大于4.4为黄色,3.1-~4.4的呈橙色,终点时溶液由黄色变成橙色,故A正确;
B.二氧化硫通入氯化钡溶液中,弱酸不能制强酸,不反应,加入稀硝酸后,硝酸氧化亚硫酸,生成不溶于硝酸的硫酸钡,产生白色沉淀,故B错误;
C.新制氢氧化铜中加入葡萄糖溶液加热反应生成红色沉淀,静置后上层溶液呈无色,故C错误;
D.溴离子失电子发生氧化反应而生成溴单质,所以发生了氧化还原反应,故D错误;
故选A.
点评 本题考查指示剂、二氧化硫的性质、葡萄糖的性质以及海水提取溴单质等,题目难度不大,注意甲基橙的变色范围是pH<3.1的变红,pH>4.4的变黄,3.1-~4.4的呈橙色.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:选择题
| A. | O2和O3互为同位素 | |
| B. | 在相同的温度与压强下,等体积的O2和O3含有相同的分子数 | |
| C. | 等物质的量的O2和O3含有相同的质子数 | |
| D. | O2和O3的相互转化是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
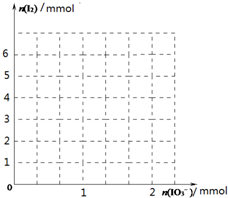 下表是某超市出售的加碘食盐的有关说明:
下表是某超市出售的加碘食盐的有关说明:| 配 料 表 | 精制盐、碘酸钾 |
| 含 碘 量 | 45±5mg/kg |
| 储 藏 方 法 | 通风、防潮 |
| 食 用 方 法 | 根据烹调所需适量加入 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

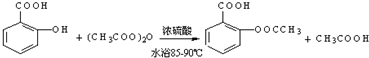 ;反应类型取代反应;
;反应类型取代反应;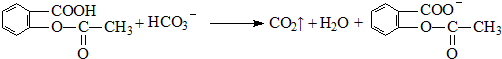 、
、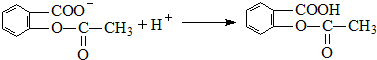 ;
;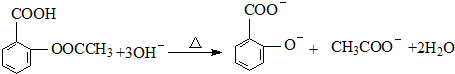 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙醇中含有的氧原子数为NA | |
| B. | 标准状况下,22.4L37Cl2中所含中子数为40NA | |
| C. | 将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA个Fe3+ | |
| D. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有OH-数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.0015 g•cm-3 | B. | 0.0012 g•cm-3 | C. | 0.0024 g•cm-3 | D. | 0.002 g•cm-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性强弱:I>Br>Cl | B. | 原子半径大小:Na>P>S | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 金属性强弱:Na>Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
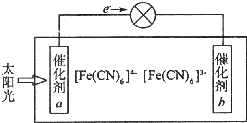 铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题.
铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A和B一定是同分异构体 | |
| B. | A和B不可能是同系物 | |
| C. | A和B的最简式相同 | |
| D. | A和B各1mol完全燃烧后生成的二氧化碳的质量一定相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com