
【题目】运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义。
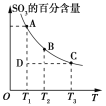
(1)硫酸生产过程中2SO2(g)+O2(g)![]() 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据如图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据如图回答下列问题:
①2SO2(g)+O2(g)![]() 2SO3(g)的ΔH________0(填“>”或“<”)。
2SO3(g)的ΔH________0(填“>”或“<”)。
②一定条件下,将SO2与O2以体积比为2︰1置于一体积不变的密闭容器中发生反应,能说明该反应已达到平衡的是________(填选项字母)。
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量分数不再变化
d.单位时间内转移4 mol电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
(2)一定条件下,合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g)。图1表示在此反应过程中的能量变化,图2表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量变化,图2表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
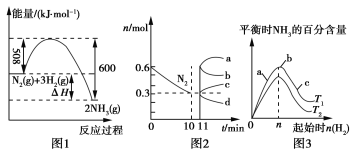
①该反应的平衡常数表达式为________,升高温度,平衡常数________(填“增大”“减小”或“不变”)。
②由图2信息,计算0~10 min内该反应的平均速率v(H2)________,从11 min起其他条件不变,压缩容器的体积为1 L,则n(N2)的变化曲线为________(填“a”“b”“c”或“d”)。
③图3a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是________点,温度T1________T2(填“>”“=”或“<”)。
【答案】(13分,除标明外,每空2分)
(1)①<(1分) ②be
(2)①K=c2(NH3)/[c(N2)×c3(H2)](1分) 减小
②0.045 mol/(L·min) d
③c(1分) <
【解析】(1)①由题图可知,横轴代表温度,纵轴代表SO3的百分含量,随温度升高,SO3的百分含量减小,所以此反应的ΔH<0。②反应前后气体总质量不变,容器体积不变,所以密度不变不能说明反应已达到平衡,a错误;二氧化硫和三氧化硫的体积比保持不变说明已达反应平衡,b正确;体系中总质量不变,硫元素的质量不变,所以硫元素的质量分数不变不能说明反应已达平衡,c错误;单位时间内转移4 mol电子,同时消耗2 mol SO3,不能说明反应已达到平衡,d错误;此反应是一个反应前后气体分子总数不相等的反应,气体分子总数不变说明反应已达到平衡,e正确。
(2)①由反应的方程式得到平衡常数表达式:K=c2(NH3)/[c(N2)×c3(H2)],由图1可知,该反应的正反应为放热反应,所以升高温度,平衡常数减小。②0~10 min,N2的物质的量减小0.3 mol,则v(N2)==0.015 mol/(L·min),v(H2)=0.045 mol/(L·min)。压缩容器的体积为1 L,缩小体积即增大压强,平衡正向移动,氮气的物质的量逐渐减小,所以表示氮气物质的量变化的曲线为d。③起始时n(H2)越大,N2的转化率越高;起始时n(H2)一定时,温度越高,平衡时NH3的百分含量越低。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化学与生活、生产密切相关。下列说法正确的是
A. KA1(SO4)2·12H2O常用于杀菌消毒
B. 生活中可用无水乙醇消毒
C. 纤维素在人体内水解得到葡萄糖
D. 泡沫灭火器中的反应物是NaHCO3和Al2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g) + CO(g)![]() CH3OH(g)
CH3OH(g)
下表所列数据是该反应在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
(1)该反应的平衡常数表达式K=_____________,△H_________0(填“>”、“<”或“=”)。
(2)要提高CO的转化率,可以采取的措施是_____________(填序号)。
a.升温
b.加入催化剂
c.增加CO的浓度
d.恒容加入H2加压
e.恒容加入惰性气体加压
f.分离出甲醇
(3)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是_____(填字母)。
A.c(H2)减少B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加 D.重新平衡时c(H2)/ c(CH3OH)减小
(4)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)= 0.2 mol/L,则CO的转化率为__________,此时的温度为________。以CH3OH表示该过程的反应速率v(CH3OH)=_________mol /(L · min)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲表示麦芽糖酶催化麦芽糖水解的模型,图乙表示在最适温度下,麦芽糖酶的催化速率与麦芽糖量的关系。

(1)该模型能解释酶的催化具有专一性,酶的专一性是指 __________ ,图中d和e代表 。
(2)限制g~h上升的原因是 ,如果温度升高5℃,g点将 (填“上移”或“不变”或“下移”),原因是 。
(3)能否用斐林试剂鉴定麦芽糖酶是否完成对麦芽糖的催化分解? (填“能”或“不能”)
(4)在3支试管中分别加入2mL 3%的可溶性淀粉溶液,并分别放到沸水、热水(约60℃)和冰块中;5min后,再在3支试管中分别加入1mL 2%的新鲜淀粉酶溶液,摇匀;5min后,又在3支试管中各滴入2滴碘液,摇匀并观察3支试管中溶液颜色的变化情况。请回答:
①该实验的目的是 。
②该实验的原理是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A. 100C时,1L pH=6纯水中含H+数目为10-6NA
B. 0.1mol·L-1 Na2CO3溶液中,Na+的数目为0.2NA
C. 常温常压下,17g羟基(—18OH)所含中子数为9NA
D. 标准状况下,22.4L CHCl3中所含C—Cl键的数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取成熟到第2天和第4天的等量香蕉果肉,分别加等量的蒸馏水制成提取液,然后在a、c试管中各加5mL第2天的提取液,在b、d试管中各加5mL第4天的提取液。如图:在a、b试管中各加入等量碘液,在c、d试管中各加入等量的斐林试剂,煮沸。观察比较颜色变化,结果是 ( )

A.a、b试管呈蓝色,且a比b颜色浅;c、d试管呈砖红色,且c比d颜色浅
B.a、b试管呈蓝色,且a比b颜色深;c、d试管呈砖红色,且c比d颜色浅
C.a、b试管呈蓝色,且a比b颜色浅;c、d试管呈砖红色,且c比d颜色深
D.a、b试管呈蓝色,且a比b颜色深;c、d试管呈砖红色,且c比d颜色深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是

A. 该反应进行到M点放出的热量大于进行到W点放出的热量
B. T2下,在0~t1时间内,υ(Y)=a-b/t1 mol/(L·min)
C. M点的正反应速率υ(正)大于N点的逆反应速率υ(逆)
D. M点时再加入一定量的X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,CH3COONa溶液显碱性,是因为( )
A. CH3COO—电离出了OH— B. CH3COO—结合了水电离的H+
C. Na+和水反应生成了NaOH D. Na+促进了水的电离
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com