
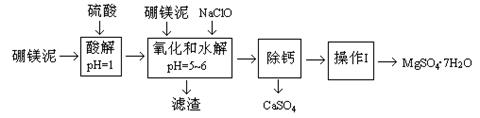
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |


科目:高中化学 来源:不详 题型:填空题
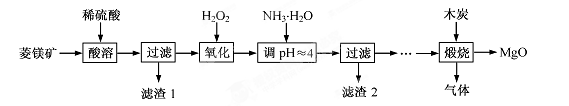
 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑ MgO+SO2↑+CO↑
MgO+SO2↑+CO↑ MgO+S↑+3CO↑
MgO+S↑+3CO↑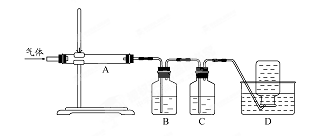
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

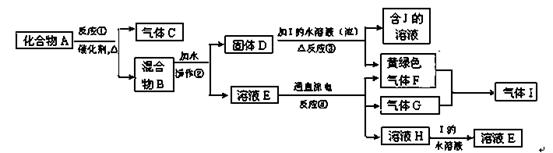
查看答案和解析>>
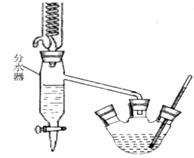
科目:高中化学 来源:不详 题型:实验题



查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
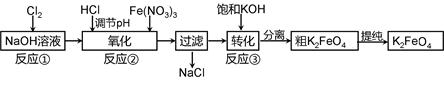
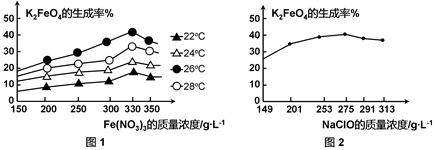
 4Fe(OH)3 + 8OH- + 3O2。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号)。
4Fe(OH)3 + 8OH- + 3O2。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号)。| A.H2O | B.CH3COONa、异丙醇 | C.NH4Cl、异丙醇 | D.Fe(NO3)3、异丙醇 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
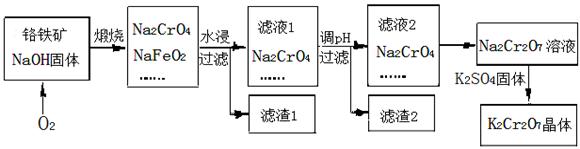
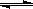 2CrO42- + 2H+
2CrO42- + 2H+| A.蒸馏水 | B.酒精 | C.稀硫酸 | D.饱和K2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
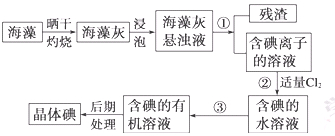
| A.酒精 | B.四氯化碳 | C.汽油 | D.醋酸 |
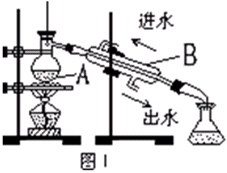
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com