
【题目】向某密闭容器中加入0.15 mol·L-1 A、0.05 mol·L-1 C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图中甲图所示[t0~t1时c(B)未画出,t1时c(B)增大到0.05 mol·L-1]。乙图为t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。
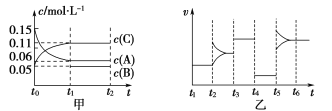
(1)若t4时改变的条件为减小压强,则B的起始物质的量浓度为___mol·L-1。
(2)若t5时改变的条件是升温,此时v(正)>v(逆),若A的物质的量减少0.03 mol时,容器与外界的热交换总量为a kJ,写出反应的热化学方程式:___________________________________。
(3)t3时改变的某一反应条件可能是________(填字母)。
a.使用催化剂 b.增大压强 c.增大反应物浓度
(4)在恒温恒压下通入惰性气体,v(正)________v(逆)(填“>”“=”或“<”)。
【答案】0.02 3A(g) ![]() 2C(g)+B(g) ΔH=+100a kJ·mol-1 ab =
2C(g)+B(g) ΔH=+100a kJ·mol-1 ab =
【解析】
(1)若t4时改变的条件为减小压强,平衡不移动,说明反应前后气体的体积相等,图甲中t1时到达平衡,△c(A)=0.09mol·L-1,△c(C)=0.06mol·L-1,二者化学计量数之比为0.09:0.06=3:2,则B为生成物,反应方程式为:3A(g)![]() B(g)+2C(g),计算B的浓度变化量,B的起始浓度=B的平衡浓度-B的浓度变化量,再根据n=cV计算B的起始物质的量;
B(g)+2C(g),计算B的浓度变化量,B的起始浓度=B的平衡浓度-B的浓度变化量,再根据n=cV计算B的起始物质的量;
(2)若t5时改变的条件是升温,此时v(正)>v(逆),平衡正向移动,正反应为吸热反应,若A的物质的量减少0.03mol时,容器与外界的热交换总量为a kJ,则3mol A反应放出的吸收的热量为akJ×3mol/0.03mol=100a kJ,注明物质聚集状态与反应热书写热化学方程式;
(3)t3 时改变条件瞬间正逆速率都增大,平衡不移动,反应前后气体体积不变,可能是增大压强,或使用催化剂;
(4)在恒温恒压下通入惰性气体,平衡不发生移动;
(1)根据题意:A、C的化学计量数之比为0.09∶0.06=3∶2,再根据改变压强,平衡不移动可知反应为等体积反应,所以方程式为3A(g) ![]() 2C(g)+B(g)。故c(B)=(0.05-0.03) mol·L-1=0.02 mol·L-1。
2C(g)+B(g)。故c(B)=(0.05-0.03) mol·L-1=0.02 mol·L-1。
(2)升温,v(正)>v(逆),反应为吸热反应,故热化学方程式为3A(g)![]() B(g)+2C(g) ΔH=+100a kJ·mol1。
B(g)+2C(g) ΔH=+100a kJ·mol1。
(3)t3时,改变条件,v(正)=v(逆)、增大,又因反应为等体积反应,故条件为增大压强或使用催化剂。故选ab。
(4)恒温恒压下通入惰性气体,相当于减压,等体积反应平衡不移动,v(正)=v(逆)。


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是白色砂状或淡黄色粉末状固体,易溶于水、不溶于醇,该物质具有强还原性,在空气中易被氧化为NaHSO4,75℃以上会分解产生SO2。是重要的有机合成原料和漂白剂。
制取Na2S2O4常用甲酸钠法:控制温度60~70℃,在甲酸钠(HCOONa)的甲醇溶液中,边搅拌边滴加Na2CO3甲醇溶液,同时通入SO2,即可生成Na2S2O4。反应原理如下:2HCOONa+4SO2+Na2CO3=2Na2S2O4+H2O+3CO2

(1)如图,要制备并收集干燥纯净的SO2气体,接口连接的顺序为:a接__,__接__,__接__。制备SO2的化学方程式为___。
(2)实验室用图装置制备Na2S2O4。

①Na2S2O4中硫元素的化合价为___。
②仪器A的名称是___。
③水浴加热前要通一段时间N2,目的是___。
④为得到较纯的连二亚硫酸钠,需要对在过滤时得到的连二亚硫酸纳进行洗涤,洗涤的方法是___。
⑤若实验中所用Na2SO3的质量为6.3g,充分反应后,最终得到mg纯净的连二亚硫酸钠,则连二亚硫酸钠的产率为___(用含m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.草酸与高锰酸钾在酸性条件下能够发生如反应:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,用 4mL 0.001mol/L KMnO4 溶液与2mL 0.01mol/L H2C2O4 溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
Ⅰ | 2mL | 20 | |
Ⅱ | 2mL | 20 | 10 滴饱和 MnSO4 溶液 |
Ⅲ | 2mL | 30 | |
Ⅳ | 1mL | 20 | 1mL 蒸馏水 |
(1)该反应中氧化剂和还原剂的物质的量之比为_____
(2)如果研究催化剂对化学反应速率的影响,使用实验_________和_____(用Ⅰ~Ⅳ表示,下同); 如果研究温度对化学反应速率的影响,使用实验_____和_________.
(3)对比实验Ⅰ和Ⅳ,可以研究_____对化学反应速率的影响,实验Ⅳ中加入 1mL蒸馏水的目的是_______
II、利用如图装置采用适当试剂可完成某探究实验,并得出相应实验结论.请根据相关信息回答:

(1)为了证明元素的非金属性强弱是 S>C>Si.你认为各物质应该是: 甲为______;乙为______;丙为______.(已知乙中有气泡产生,丙中 有白色沉淀)
(2)如果甲为水,乙为 Na2O2 粉末,丙为 H2S 的饱和水溶液.实验中观察到丙中生成淡黄色沉淀。说明元素O、S得电子能力强弱为 ______。
(3)将该装置连接好后,在加入药品开始实验前还需进行气密性检查,请你简述该操作_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产生活中广泛存在。
(1)①氯胺(NH2Cl)的电子式为________。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如右表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH=_________。
化学键 | 键能/(kJ·mol-1) |
N-H | 391.3 |
Cl-Cl | 243.0 |
N-Cl | 191.2 |
H-Cl | 431.8 |
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为____________(填“放热”或“吸热”)反应。
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=_________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B两点的浓度平衡常数关系:Kc(A)_____Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是______(填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲探究CO还原CuO,设计如图所示装置(夹持装置略去)。下列说法正确的是

A. ②、④中均可盛装碱石灰
B. 加热的顺序为③、①、⑤
C. ①、③、⑤中均发生氧化还原反应
D. 可将尾气用导管通入到⑤的酒精灯处灼烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】久置的FeSO4溶液变黄,一般认为是被氧化为的缘故。回答下列问题:
(1)久置的FeSO4溶液中Fe3+的检验:
向久置的FeSO4溶液中加入KSCN的现象为:______________________________,向含有Fe3+久置的FeSO4溶液中加入少量KI—淀粉溶液,发现溶液变蓝,反应的离子方程式:________________________________________。
(2)除去久置FeSO4溶液中Fe3+:
在溶液中加入少量铁粉,可以观察到的现象为______________________;反应的离子方程式为:_____________________________,不能用铜粉作为除去FeSO4溶液中Fe3+试剂的原因:__________________________。
(3)查阅资料:溶液中Fe2+的氧化过程分为两步,首先是Fe2+水解为Fe(OH)2,接着水解产物被O2氧化。
写出Fe(OH)2在空气中被氧化的化学方程式:________________________________,其现象为:__________________________________________________
(4)某研究小组研究常温下不同pH对Fe2+被O2氧化的影响,如图。结合图分析不同pH对Fe2+被O2氧化的反应产生了怎样的影响:___________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下列装置可测量一定质量的钢材中的含碳量(部分加持装置已略去)。下列有关判断正确的是( )

A. 实验时,先打开K1、K2,关闭K3,从a处通入N2,目的是排出装置中的O2
B. 点燃酒精灯前,需要打开K1、关闭K2,打开K3、K1起到平衡气压的作用
C. 装置②中的酸性KMnO4溶液吸收SO2,装置③盛有浓硫酸,起到干燥作用
D. 实验前后需称取装置④和装置⑤的质量,才能准确地测得钢材的含碳量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列反应的化学方程式。
(1)铁做催化剂,苯与溴单质反应_________________;
(2)CH3CH2CH2OH发生消去反应生成丙烯_____________;
(3)苯乙烯(![]() )在适当引发剂作用下生成聚苯乙烯_________________________。
)在适当引发剂作用下生成聚苯乙烯_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列热化学反应方程式:
(1)1mol硫酸和氢氧化钠稀溶液反应放出115kJ热量,写出表示中和热的热化学反应方程式__。
(2)0.5molC2H5OH(l)完全燃烧生成液态水放出683.4kJ热量,写出表示C2H5OH燃烧热热化学反应方程式___。
(3)24g碳与适量H2O(g)反应吸收262.6kJ热量__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com