


科目:高中化学 来源: 题型:
 (2010?湖北)在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L 及 c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.
(2010?湖北)在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L 及 c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:



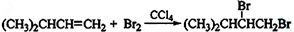
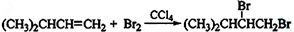
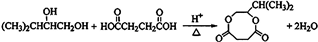
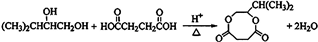




查看答案和解析>>
科目:高中化学 来源: 题型:
 (2010?湖北模拟)如图为某有机物的结构简式.已知酯类在铜铬氧化物(CuO?CuCrO4)催化下,与氢气反应得到醇,羰基双键可同时被还原,但苯环在催化氢化过程中不变,其反应原理如下:在铜铬氧化物催化下,R1COOR2+2H2→R1CH2OH+R2OH
(2010?湖北模拟)如图为某有机物的结构简式.已知酯类在铜铬氧化物(CuO?CuCrO4)催化下,与氢气反应得到醇,羰基双键可同时被还原,但苯环在催化氢化过程中不变,其反应原理如下:在铜铬氧化物催化下,R1COOR2+2H2→R1CH2OH+R2OH查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com