
分析 KBrO3能把KI氧化成I2或KIO3,氧化性:BrO3->I03-,KIO3能把KBr氧化生成Br2,氧化性:I03->Br2,氧化性:Br2>I2,所以氧化性:KBrO3>KIO3>Br2,从电荷守恒、质量守恒以及氧化还原反应中得失电子数目相等的角度配平化学方程式.
解答 解:KBrO3能把KI氧化成I2或KIO3,氧化性:BrO3->I03-,KIO3能把KBr氧化生成Br2,氧化性:I03->Br2,氧化性:Br2>I2,所以氧化性:KBrO3>KIO3>Br2,溶液中有稀H2SO4、KBrO3、KI,反应产物有两种情况,分别为:
①KI+KBrO3+H2SO4→I2+Br2+K2SO4+H2O中,反应中Br元素化合价由+5价降为0价,I元素化合价由-1价升高为0价,二者在反应中得失电子数目相等,则有二者的计量数比值为1:5,根据电子守恒、原子守恒,可配平衡方程式为:10KI+2KBrO3+6H2SO4=5I2+Br2+6K2SO4+6H2O,
②KI+KBrO3+H2SO4→KIO3+Br2+K2SO4+H2O中,反应中Br元素化合价由+5价降为0价,I元素化合价由-1价升高为+5价,二者在反应中得失电子数目相等,则有二者的计量数比值为6:5,根据电子守恒、原子守恒,可配平衡方程式为:5KI+6KBrO3+3H2SO4=5KIO3+3Br2+3K2SO4+3H2O,
故答案为:10KI+2KBrO3+6H2SO4=5I2+Br2+6K2SO4+6H2O;5KI+6KBrO3+3H2SO4=5KIO3+3Br2+3K2SO4+3H2O.
点评 本题考查氧化还原反应方程式的书写,注意从化合价变化的角度、氧化还原反应得失电子相等的角度分析氧化还原反应,侧重分析能力的综合考查,题目难度中等.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. |  向HCl和AlCl3的混合液中滴加NaOH溶液 | |
| B. |  向NaOH和Ca(OH)2的混合液中通入CO2 | |
| C. |  向NH4Al(SO4)2溶液中滴加 Ba(OH)2溶液 | |
| D. |  向NaOH和Na2CO3的混合液中滴加稀HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 碳酸钠溶液可用于治疗胃病 | Na2CO3可与盐酸反应 | Ⅰ对,Ⅱ对,有 |
| B | 向Na2O2的水溶液中滴入酚酞变红色 | Na2O2与水反应生成氢氧化钠 | Ⅰ对,Ⅱ错,无 |
| C | 金属钠具有强还原性 | 高压钠灯发出透雾能力强的黄光 | Ⅰ对,Ⅱ对,有 |
| D | 过氧化钠可为航天员供氧 | Na2O2能与CO2和H2O反应生成O2 | Ⅰ对,Ⅱ对,有 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④⑤ | C. | ①③⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
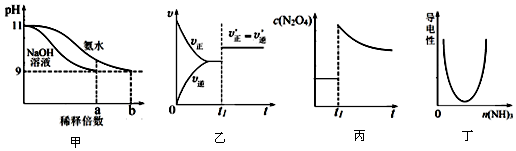
| A. | 图甲表示分别稀释pH=11的NaOH溶液和氨水时溶液pH的变化,图中b>a=100 | |
| B. | 图乙表示某化学平衡的移动,在t1时改变的条件一定是加入催化剂 | |
| C. | 图丙表示平衡2NO2(g)?N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 | |
| D. | 图丁表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
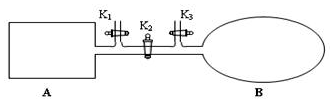 我国于2016年10月17日在酒泉卫星发射中心由“长征二号”FY11运载火箭发射“神舟十一号”载人飞船.“长征二号”FY11运载火箭使用的氧化剂是N2O4.如图,A是由导热材料制成的恒容密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,通过K1、K3分别向容器A、气囊B中充入1molNO2,发生反应:2NO2(g)?N2O4(g).反应起始时A、B的体积均为1L.
我国于2016年10月17日在酒泉卫星发射中心由“长征二号”FY11运载火箭发射“神舟十一号”载人飞船.“长征二号”FY11运载火箭使用的氧化剂是N2O4.如图,A是由导热材料制成的恒容密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,通过K1、K3分别向容器A、气囊B中充入1molNO2,发生反应:2NO2(g)?N2O4(g).反应起始时A、B的体积均为1L.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
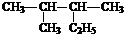 2,3-二甲基戊烷
2,3-二甲基戊烷查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com